| DCI | Adalimumab |
| ATC | L04AB04 |
| CLASSE | Immunosuppresseur - Anti-TNF-α |
Référence
HUMIRA® (Adalimumab)
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Arthrite juvénile idiopathique polyarticulaire évolutive chez l'enfant et l'adolescent de 2 à 17 ans
Les données cliniques disponibles suggèrent que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être soigneusement reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Arthrite liée à l'enthésite chez l'enfant à partir de 6 ans en cas de réponse insuffisante ou d'intolérance au traitement conventionnel.
Indications thérapeutiques
Arthrite juvénile idiopathique polyarticulaire
HUKYNDRA® en association au méthotrexate est indiqué dans le traitement de l’arthrite juvénile idiopathique polyarticulaire évolutive chez les patients à partir de 2 ans en cas de réponse insuffisante à un ou plusieurs traitements de Fond. HUKYNDRA® peut être administré en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée.
Arthrite liée à l’enthésite
HUKYNDRA® est indiqué dans le traitement de l’arthrite active liée à l’enthésite chez les patients à partir de 6 ans, en cas de réponse insuffisante ou d’intolérance au traitement conventionnel
Arthrite juvénile idiopathique polyarticulaire
HUKYNDRA® en association au méthotrexate est indiqué dans le traitement de l’arthrite juvénile idiopathique polyarticulaire évolutive chez les patients à partir de 2 ans en cas de réponse insuffisante à un ou plusieurs traitements de Fond. HUKYNDRA® peut être administré en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée.
Arthrite liée à l’enthésite
HUKYNDRA® est indiqué dans le traitement de l’arthrite active liée à l’enthésite chez les patients à partir de 6 ans, en cas de réponse insuffisante ou d’intolérance au traitement conventionnel
Population adulte
Pas d'indication chez l'adulte.
Pas d'indication chez l'adulte.
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Arthrite juvénile idiopathique polyarticulaire évolutive chez l'enfant et l'adolescent de 2 à 17 ans
- Enfant de 10 à 30 kg : 20 mg toutes les 2 semaines
- Enfant ≥ 30 kg : 40 mg toutes les 2 semaines
Les données cliniques disponibles suggèrent que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être soigneusement reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Arthrite liée à l'enthésite chez l'enfant à partir de 6 ans en cas de réponse insuffisante ou d'intolérance au traitement conventionnel.
- Enfant de 15 à 30 kg : 20 mg toutes les 2 semaines
- Enfant ≥ 30 kg : 40 mg toutes les 2 semaines
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ROACTEMRA® (Tocilizumab)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- ORENCIA® (Abatacept)
- SIMPONI® (Golimumab)
- YUFLYMA® (Adalimumab)
- AMSPARITY® (Adalimumab)
Pour aller plus loin
- Stratégie thérapeutique : HAS 2020
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Pas de remboursement chez les enfants.
Indications thérapeutiques
HUKYNDRA® est indiqué dans le traitement de l’HS (maladie de Verneuil) active, modérée à sévère, chez les adultes et les adolescents à partir de 12 ans, en cas de réponse insuffisante au traitement systémique conventionnel de l’HS.
HUKYNDRA® est indiqué dans le traitement de l’HS (maladie de Verneuil) active, modérée à sévère, chez les adultes et les adolescents à partir de 12 ans, en cas de réponse insuffisante au traitement systémique conventionnel de l’HS.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Si nécessaire, les antibiotiques peuvent être poursuivis au cours du traitement. Au cours du traitement, il est recommandé au patient de nettoyer quotidiennement ses lésions avec un antiseptique topique.
La poursuite du traitement au-delà de 12 semaines doit être soigneusement reconsidérée chez les patients ne présentant pas d'amélioration pendant cette période.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- Dose initiale de 160 mg à J1 (4 inj. de 40 mg sur un jour ou 2 inj. de 40 mg/j pendant 2 jours consécutifs, puis 80 mg à J15 (en 2 inj. de 40 mg sur un jour) puis à J29, 40 mg toutes les semaines ou 80 mg toutes les deux semaines .
Si nécessaire, les antibiotiques peuvent être poursuivis au cours du traitement. Au cours du traitement, il est recommandé au patient de nettoyer quotidiennement ses lésions avec un antiseptique topique.
La poursuite du traitement au-delà de 12 semaines doit être soigneusement reconsidérée chez les patients ne présentant pas d'amélioration pendant cette période.
 Posologie population pédiatrique
Posologie population pédiatrique
Pas de remboursement chez les enfants.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
Pour aller plus loin
- Stratégie thérapeutique : Société française de dermatologie 2019
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfants & adolescents de 6 à 17 ans
Enfants et adolescents < 40 kg :
Enfants et adolescents ≥ 40 kg :
La poursuite du traitement devra être soigneusement reconsidérée chez un patient n’ayant pas répondu à la semaine 12.
Indications thérapeutiques
HUKYNDRA® est indiqué dans le traitement de la maladie de Crohn active modérée à sévère, chez les patients adultes qui n’ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur ; ou chez lesquels ce traitement est contre-indiqué ou mal toléré.
HUKYNDRA® est indiqué dans le traitement de la maladie de Crohn active modérée à sévère chez les enfants à partir de 6 ans qui n’ont pas répondu à un traitement conventionnel comprenant un traitement nutritionnel de première intention et un corticoïde et/ou un immunomodulateur, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
HUKYNDRA® est indiqué dans le traitement de la maladie de Crohn active modérée à sévère, chez les patients adultes qui n’ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur ; ou chez lesquels ce traitement est contre-indiqué ou mal toléré.
HUKYNDRA® est indiqué dans le traitement de la maladie de Crohn active modérée à sévère chez les enfants à partir de 6 ans qui n’ont pas répondu à un traitement conventionnel comprenant un traitement nutritionnel de première intention et un corticoïde et/ou un immunomodulateur, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Certains patients chez qui une diminution de la réponse au traitement par HUKYNDRA® 40 mg toutes les deux semaines est observée peuvent bénéficier d’une augmentation de la posologie à 40 mg d’HUKYNDRA® toutes les semaines ou 80 mg toutes les deux semaines.
Certains patients n’ayant pas répondu au traitement à la semaine 4 peuvent poursuivre le traitement d’entretien jusqu’à la semaine 12. La poursuite du traitement devra être soigneusement reconsidérée chez un patient n’ayant pas répondu dans ces délais.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- Traitement d'induction : 80 mg à la semaine 0 (S0) et 40 mg à la semaine 2 (S2), puis,
- En traitement d'entretien : 40 mg toutes les 2 semaines, voie SC.
Certains patients chez qui une diminution de la réponse au traitement par HUKYNDRA® 40 mg toutes les deux semaines est observée peuvent bénéficier d’une augmentation de la posologie à 40 mg d’HUKYNDRA® toutes les semaines ou 80 mg toutes les deux semaines.
Certains patients n’ayant pas répondu au traitement à la semaine 4 peuvent poursuivre le traitement d’entretien jusqu’à la semaine 12. La poursuite du traitement devra être soigneusement reconsidérée chez un patient n’ayant pas répondu dans ces délais.
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfants & adolescents de 6 à 17 ans
Enfants et adolescents < 40 kg :
- Dose d'induction de 40 mg à la semaine 0 (S0) puis 20 mg à la semaine 2 (S2) (pour une réponse plus rapide : 80 mg à S0 et 40 mg à S2). En cas de nécessité d’une réponse au traitement plus rapide, la posologie suivante peut être utilisée : 80 mg en semaine 0 et 40 mg en semaine 2.
- En traitement d'entretien : 20 mg toutes les 2 semaines - voie SC.
Enfants et adolescents ≥ 40 kg :
- Dose d'induction de 80 mg à la semaine 0 (S0) puis 40 mg à la semaine 2 (S2) (pour une réponse plus rapide : 160 mg à S0 puis 80 mg à S2). En cas de nécessité d’une réponse au traitement plus rapide, la posologie suivante peut être utilisée : 160 mg en semaine 0 et 80 mg en semaine 2.
- En traitement d'entretien : 40 mg toutes les 2 semaines.
La poursuite du traitement devra être soigneusement reconsidérée chez un patient n’ayant pas répondu à la semaine 12.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- ENTYVIO® (Vedolizumab)
- STELARA® (Ustekinumab)
- YUFLYMA® (Adalimumab)
- REMSIMA® (Infliximab)
- AMSPARITY® (Adalimumab)
- PYZCHIVA® (Ustekinumab)
- UZPRUVO® (Ustekinumab)
- WEZENLA® (Ustekinumab)
- IMULDOSA® (Ustekinumab)
- OTULFI® (Ustekinumab)
- STEQEYMA® (ustékinumab)
- YESINTEK® (ustékinumab)
Pour aller plus loin
- Stratégie thérapeutique : HAS 2021
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant
Indications thérapeutiques
HUKYNDRA® en association avec le méthotrexate, est indiqué pour :
HUKYNDRA® est pris en charge en association au méthotrexate, dans le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate ;
Adalimumab peut être donné en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
HUKYNDRA® en association avec le méthotrexate, est indiqué pour :
- le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l’adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate.
- le traitement de la polyarthrite rhumatoïde sévère, active et évolutive chez les adultes non précédemment traités par le méthotrexate. HUKYNDRA® peut être donné en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
HUKYNDRA® est pris en charge en association au méthotrexate, dans le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate ;
Adalimumab peut être donné en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
En monothérapie, certains patients chez qui l'on observe une diminution de la réponse : augmentation de la posologie à 40 mg toutes les semaines ou 80 mg toutes les 2 semaines
Les données disponibles de l’adalimumab laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être reconsidérée chez un patient n'ayant pas répondu dans ces délais.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- 40 mg en dose unique toutes les 2 semaines.
En monothérapie, certains patients chez qui l'on observe une diminution de la réponse : augmentation de la posologie à 40 mg toutes les semaines ou 80 mg toutes les 2 semaines
Les données disponibles de l’adalimumab laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement. La poursuite du traitement devra être reconsidérée chez un patient n'ayant pas répondu dans ces délais.
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ROACTEMRA® (Tocilizumab)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- KINERET® (Anakinra)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- CIMZIA® (Certolizumab pegol)
- KEVZARA® (Sarilumab)
- ORENCIA® (Abatacept)
- SIMPONI® (Golimumab)
- YUFLYMA® (Adalimumab)
- REMSIMA® (Infliximab)
- AMSPARITY® (Adalimumab)
Pour aller plus loin
- Stratégie thérapeutique : HAS 2020
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Voir indication chez l'enfant.
Indications thérapeutiques
HUKYNDRA® est indiqué dans le traitement du psoriasis en plaques chronique modéré à sévère chez les patients adultes qui nécessitent un traitement systémique.
HUKYNDRA® est pris en charge chez l'adulte dans le traitement du psoriasis en plaques sévère de l'adulte en cas d'échec, ou de contre-indication, ou d'intolérance aux autres traitements systémiques y compris la ciclosporine, le méthotrexate ou la puvathérapie.
HUKYNDRA® est indiqué dans le traitement du psoriasis en plaques chronique modéré à sévère chez les patients adultes qui nécessitent un traitement systémique.
HUKYNDRA® est pris en charge chez l'adulte dans le traitement du psoriasis en plaques sévère de l'adulte en cas d'échec, ou de contre-indication, ou d'intolérance aux autres traitements systémiques y compris la ciclosporine, le méthotrexate ou la puvathérapie.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Au-delà de 16 semaines et en cas de réponse insuffisante : augmentation de la fréquence d'administration à 40 mg toutes les semaines ou 80 mg toutes les deux semaines. En cas de réponse suffisante obtenue avec 40 mg toutes les semaines ou 80 mg toutes les deux semaines, la posologie peut ensuite être réduite à 40 mg toutes les 2 semaines.
La poursuite du traitement au-delà de 16 semaines doit être soigneusement reconsidérée chez un patient n’ayant pas répondu dans ces délais.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- Dose initiale (S0): 80 mg
- Dose d'entretien (S1): 40 mg une semaine sur 2 par voie SC
Au-delà de 16 semaines et en cas de réponse insuffisante : augmentation de la fréquence d'administration à 40 mg toutes les semaines ou 80 mg toutes les deux semaines. En cas de réponse suffisante obtenue avec 40 mg toutes les semaines ou 80 mg toutes les deux semaines, la posologie peut ensuite être réduite à 40 mg toutes les 2 semaines.
La poursuite du traitement au-delà de 16 semaines doit être soigneusement reconsidérée chez un patient n’ayant pas répondu dans ces délais.
 Posologie population pédiatrique
Posologie population pédiatrique
Voir indication chez l'enfant.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- CIMZIA® (Certolizumab pegol)
- TREMFYA® (Guselkumab)
- TALTZ® (Ixékizumab)
- KYNTHEUM® (Brodalumab)
- COSENTYX® (Sécukinumab)
- ILUMETRI® (Tildrakizumab)
- SKYRIZI® (Risankizumab)
- YUFLYMA® (Adalimumab)
- REMSIMA® (Infliximab)
- AMSPARITY® (Adalimumab)
- BIMZELX® (Bimekizumab)
- PYZCHIVA® (Ustekinumab)
- UZPRUVO® (Ustekinumab)
- WEZENLA® (Ustekinumab)
- STELARA® (Ustekinumab)
- IMULDOSA® (Ustekinumab)
- OTULFI® (Ustekinumab)
- STEQEYMA® (ustékinumab)
- YESINTEK® (ustékinumab)
Pour aller plus loin
- Stratégie thérapeutique : HAS 2021
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfants & adolescents à partir de 4 ans
La poursuite du traitement au-delà de 16 semaines doit être soigneusement reconsidérée chez un patient n’ayant pas répondu dans ces délais.
Indications thérapeutiques
HUKYNDRA® est indiqué pour le traitement du psoriasis en plaques chronique sévère chez les enfants partir de 4 ans et les adolescents en cas de réponse insuffisante à un traitement topique et aux photothérapies ou lorsque ces traitements sont inappropriés.
HUKYNDRA® est pris en charge dans le traitement du psoriasis en plaques chronique sévère de l'enfant à partir de 4 ans, de l'adolescent et de l'adulte, défini par : un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie et une forme étendue et/ou un retentissement psychosocial important.
HUKYNDRA® est indiqué pour le traitement du psoriasis en plaques chronique sévère chez les enfants partir de 4 ans et les adolescents en cas de réponse insuffisante à un traitement topique et aux photothérapies ou lorsque ces traitements sont inappropriés.
HUKYNDRA® est pris en charge dans le traitement du psoriasis en plaques chronique sévère de l'enfant à partir de 4 ans, de l'adolescent et de l'adulte, défini par : un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie et une forme étendue et/ou un retentissement psychosocial important.
Population adulte
Voir indication chez l'adulte.
Voir indication chez l'adulte.
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfants & adolescents à partir de 4 ans
- Enfant de 15 à 30 kg : dose initiale de 20 mg puis 20 mg toutes les 2 semaines en commençant une semaine après l'administration de la dose initiale.
- Enfant ≥ 30 kg : dose initiale de 40 mg puis 40 mg toutes les 2 semaines en commençant une semaine après l'administration de la dose initiale.
La poursuite du traitement au-delà de 16 semaines doit être soigneusement reconsidérée chez un patient n’ayant pas répondu dans ces délais.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- STELARA® (Ustekinumab)
- YUFLYMA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- HYRIMOZ® (Adalimumab)
- IDACIO® (Adalimumab)
- IMRALDI® (Adalimumab)
- UZPRUVO® (Ustekinumab)
- WEZENLA® (Ustekinumab)
- IMULDOSA® (Ustekinumab)
- OTULFI® (Ustekinumab)
- PYZCHIVA® (Ustekinumab)
- STEQEYMA® (ustékinumab)
- YESINTEK® (ustékinumab)
Pour aller plus loin
- Stratégie thérapeutique : HAS 2021
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfants et adolescents de 6 à 17 ans
La poursuite du traitement au‑delà de 8 semaines doit être soigneusement reconsidérée chez les patients n’ayant pas répondu pendant cette période.
Indications thérapeutiques
HUKYNDRA® est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6‑mercaptopurine (6‑MP) ou l’azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
HUKYNDRA® est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients pédiatriques (à partir de 6 ans) ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6-mercaptopurine (6-MP) ou l’azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
HUKYNDRA® est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6‑mercaptopurine (6‑MP) ou l’azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
HUKYNDRA® est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère chez les patients pédiatriques (à partir de 6 ans) ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6-mercaptopurine (6-MP) ou l’azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Certains patients chez qui on observe ne diminution de la réponse peuvent bénéficier d’une augmentation de la posologie à 40 mg toutes les semaines ou 80 mg toutes les deux semaines.
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 2 à 8 semaines de traitement. Le traitement ne doit pas être poursuivi chez les patients n’ayant pas répondu dans ces délais.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- Traitement d'induction : 160 mg à la semaine 0 (4 inj. de 40 mg sur 1 jour; 2 inj. de 40 mg / jour x 2 jours consécutifs) et 80 mg à la semaine 2 (2 inj. de 40 mg / j), puis,
- Traitement d'entretien : 40 mg toutes les 2 semaines.
Certains patients chez qui on observe ne diminution de la réponse peuvent bénéficier d’une augmentation de la posologie à 40 mg toutes les semaines ou 80 mg toutes les deux semaines.
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 2 à 8 semaines de traitement. Le traitement ne doit pas être poursuivi chez les patients n’ayant pas répondu dans ces délais.
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfants et adolescents de 6 à 17 ans
- Enfant < 40 kg : dose d'induction de 80 mg à la semaine 0 (2 inj. de 40 mg et 40 mg à la semaine 2 (1 seule inj. de 40 mg) puis 40 mg toutes les 2 semaines à partir de la semaine 4
- Enfant > 40 kg : dose d'induction de 160 mg à la semaine 0 (4 inj.de 40 mg ou 2 inj. De 40 mg / jour x 2 jours) et 80 mg à la semaine 2 (2 inj. de 40 mg) puis 80 mg toutes les 2 semaines à partir de la semaine 4
La poursuite du traitement au‑delà de 8 semaines doit être soigneusement reconsidérée chez les patients n’ayant pas répondu pendant cette période.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
Pour aller plus loin
- Stratégie thérapeutique : HAS 2020
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant
Indications thérapeutiques
HUKYNDRA® est indiqué pour le traitement du rhumatisme psoriasique actif et évolutif chez l’adulte lorsque la réponse à un traitement de fond antérieur a été inadéquate.
Il a été montré qu’adalimumab ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par radiographie, chez les patients ayant des formes polyarticulaires symétriques de la maladie et améliore les capacités fonctionnelles.
HUKYNDRA® est indiqué pour le traitement du rhumatisme psoriasique actif et évolutif chez l’adulte lorsque la réponse à un traitement de fond antérieur a été inadéquate.
Il a été montré qu’adalimumab ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par radiographie, chez les patients ayant des formes polyarticulaires symétriques de la maladie et améliore les capacités fonctionnelles.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- 40 mg en dose unique toutes les 2 semaines
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement.
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- CIMZIA® (Certolizumab pegol)
- TREMFYA® (Guselkumab)
- TALTZ® (Ixékizumab)
- COSENTYX® (Sécukinumab)
- SIMPONI® (Golimumab)
- STELARA® (Ustekinumab)
- SKYRIZI® (Risankizumab)
- YUFLYMA® (Adalimumab)
- REMSIMA® (Infliximab)
- AMSPARITY® (Adalimumab)
- PYZCHIVA® (Ustekinumab)
- UZPRUVO® (Ustekinumab)
- WEZENLA® (Ustekinumab)
- BIMZELX® (Bimekizumab)
- IMULDOSA® (Ustekinumab)
- OTULFI® (Ustekinumab)
- STEQEYMA® (ustékinumab)
- YESINTEK® (ustékinumab)
Pour aller plus loin
- Stratégie thérapeutique : Société française de rhumatologie 2021
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant.
Indications thérapeutiques
Spondylarthrite axiale Spondylarthrite ankylosante (SA)
HUKYNDRA® est indiqué pour le traitement de la spondylarthrite ankylosante sévère et active chez l’adulte ayant eu une réponse inadéquate au traitement conventionnel.
Spondylarthrite axiale sans signes radiographique de SA
HUKYNDRA® est indiqué dans le traitement de la spondyloarthrite axiale sévère sans signes radiographiques de SA, mais avec des signes objectifs d’inflammation à l’IRM et/ou un taux élevé de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux anti-inflammatoires non stéroïdiens (AINS).
Spondylarthrite axiale Spondylarthrite ankylosante (SA)
HUKYNDRA® est indiqué pour le traitement de la spondylarthrite ankylosante sévère et active chez l’adulte ayant eu une réponse inadéquate au traitement conventionnel.
Spondylarthrite axiale sans signes radiographique de SA
HUKYNDRA® est indiqué dans le traitement de la spondyloarthrite axiale sévère sans signes radiographiques de SA, mais avec des signes objectifs d’inflammation à l’IRM et/ou un taux élevé de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux anti-inflammatoires non stéroïdiens (AINS).
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement.
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- 40 mg en dose unique toutes les 2 semaines
Les données disponibles laissent supposer que la réponse clinique est habituellement obtenue en 12 semaines de traitement.
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- CIMZIA® (Certolizumab pegol)
- TALTZ® (Ixékizumab)
- COSENTYX® (Sécukinumab)
- SIMPONI® (Golimumab)
- YUFLYMA® (Adalimumab)
- REMSIMA® (Infliximab)
- AMSPARITY® (Adalimumab)
- BIMZELX® (Bimekizumab)
Pour aller plus loin
- Stratégie thérapeutique : Société française de rhumatologie 202
- JO du 30 avril 2021
- Données réglementaires : RCP
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfant à partir de 2 ans et l'adolescent
Indications thérapeutiques
HUKYNDRA® est indiqué dans le traitement de l’uvéite antérieure chronique non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée.
HUKYNDRA® est indiqué dans le traitement d’une uvéite pédiatrique antérieure non infectieuse chronique chez les enfants et les adolescents à partir de 2 ans en cas de réponse insuffisante ou d’intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
HUKYNDRA® est pris en charge dans le traitement de l'uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée ; En association au méthotrexate, traitement de l'uvéite antérieure chronique non infectieuse associée à une arthrite juvénile idiopathique chez l'enfant de 2 ans et l'adolescent, en cas de réponse insuffisante ou d'intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
HUKYNDRA® est indiqué dans le traitement de l’uvéite antérieure chronique non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée.
HUKYNDRA® est indiqué dans le traitement d’une uvéite pédiatrique antérieure non infectieuse chronique chez les enfants et les adolescents à partir de 2 ans en cas de réponse insuffisante ou d’intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
HUKYNDRA® est pris en charge dans le traitement de l'uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée ; En association au méthotrexate, traitement de l'uvéite antérieure chronique non infectieuse associée à une arthrite juvénile idiopathique chez l'enfant de 2 ans et l'adolescent, en cas de réponse insuffisante ou d'intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
- Dose initiale de 80 mg, puis,
- Dose d'entretien de 40 mg toutes les 2 semaines en commençant une semaine après l’administration de la première dose.
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Enfant à partir de 2 ans et l'adolescent
- Enfant < 30 kg : 20 mg toutes les 2 semaines en association au méthotrexate. Lors de l’instauration du traitement, une dose de charge de 40 mg peut être administrée une semaine avant le début du traitement d’entretien.
- Enfant ≥ 30 kg : 40 mg toutes les 2 semaines en association au méthotrexate. Lors de l’instauration du traitement, une dose de charge de 80 mg peut être administrée une semaine avant le début du traitement d’entretien.
Présentations et dosages
HUKYNDRA 40 mg sol inj en seringue préremplie - Boite de 2
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
HUKYNDRA 40 mg sol inj en stylo prérempli - Boite de 2
HUKYNDRA 80 mg sol inj en seringue préremplie - Boite de 1
HUKYNDRA 80 mg sol inj en stylo prérempli - Boite de 1
Médicaments liés à cette pathologie
Pour aller plus loin
- Stratégie thérapeutique : HAS 2018
- JO du 30 avril 2021
- Données réglementaires : RCP
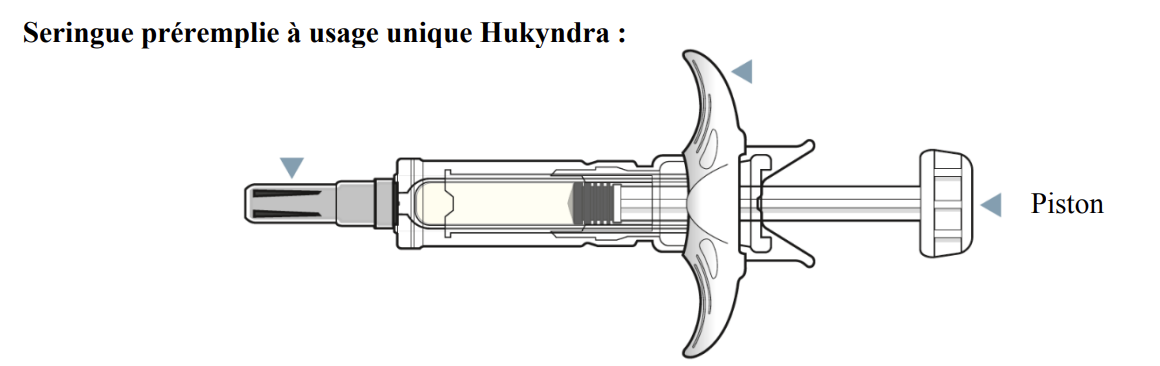
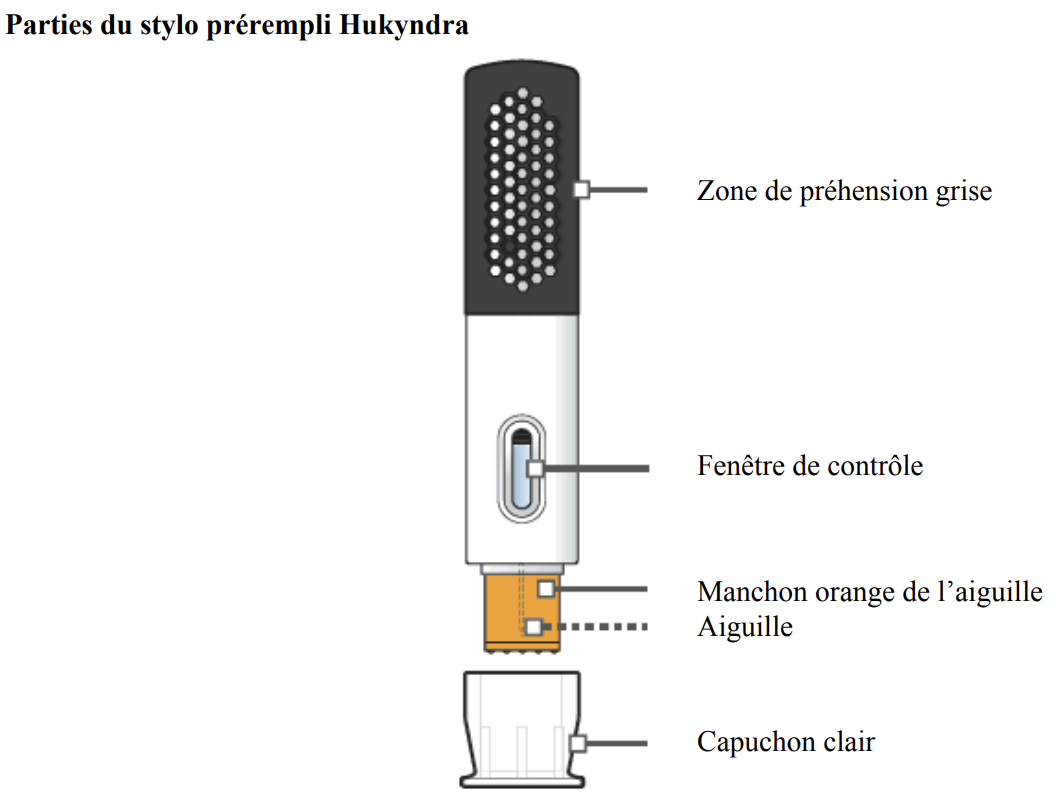
Mode d'administration
HUKYNDRA® est à administrer en injection sous la peau (voie sous-cutanée). L’auto-injection est possible après une courte formation délivrée par un professionnel de santé.
Sortir le matériel du réfrigérateur et la laisser se réchauffer à une température entre 20 °C et 25 °C pendant 15 à 30 minutes.
1 - Contrôle de la solution
2 - Choix du site d'injection
3 - Se laver les mains et désinfecter le site d'injection
4 - Injection
En cas d’utilisation d’une seringue préremplie : Retirer le capuchon en tirant la seringue préremplie avec l’autre main. Injection sous-cutanée, en pinçant la peau, soit à un angle droit soit à un angle à 45°, jusqu'à ce que l'ensemble du produit soit injecté.
En cas d'utilisation du stylo : tirer d’un seul coup le capuchon. Jeter le capuchon. Ne pas recapuchonner. Injection sous-cutanée, avec un angle de 90° à plat en pinçant ka peau. L’injection complète pourra durer jusqu’à 10 secondes après le premier « clic ». L’injection est terminée lorsque l’indicateur orange a cessé de bouger et que l'on entend un second « clic".
5 - Jeter le dispositif d'injection utilisé dans un collecteur de déchets comme indiqué par le médecin, infirmier/ère ou pharmacien. Ne pas recycler ou jeter dans les ordures ménagères.
Sortir le matériel du réfrigérateur et la laisser se réchauffer à une température entre 20 °C et 25 °C pendant 15 à 30 minutes.
1 - Contrôle de la solution
- S'assurer de la qualité du matériel et que la date de péremption n'est pas dépassée.
- Le liquide dans la seringue est limpide et incolore. Ne pas utiliser si le liquide est trouble, jauni, ou contient des flocons ou des particules.
- Il est normal de voir une ou plusieurs bulles dans la fenêtre.
2 - Choix du site d'injection
- le devant des cuisses ou le ventre (abdomen) à au moins 5 cm du nombril. A au moins 3 cm du dernier site d’injection.
- Ne pas injecter à travers les vêtements. Ne pas injecter dans une peau douloureuse, contusionnée, rouge, dure, présentant des cicatrices, avec des vergetures, ou au niveau de plaques de psoriasis.
3 - Se laver les mains et désinfecter le site d'injection
4 - Injection
En cas d’utilisation d’une seringue préremplie : Retirer le capuchon en tirant la seringue préremplie avec l’autre main. Injection sous-cutanée, en pinçant la peau, soit à un angle droit soit à un angle à 45°, jusqu'à ce que l'ensemble du produit soit injecté.
En cas d'utilisation du stylo : tirer d’un seul coup le capuchon. Jeter le capuchon. Ne pas recapuchonner. Injection sous-cutanée, avec un angle de 90° à plat en pinçant ka peau. L’injection complète pourra durer jusqu’à 10 secondes après le premier « clic ». L’injection est terminée lorsque l’indicateur orange a cessé de bouger et que l'on entend un second « clic".
5 - Jeter le dispositif d'injection utilisé dans un collecteur de déchets comme indiqué par le médecin, infirmier/ère ou pharmacien. Ne pas recycler ou jeter dans les ordures ménagères.
Effets indésirables les plus fréquents
Affections généraux et réactions au site d’administration : réaction au site d’injection (y compris érythème au site d’injection), douleur thoracique, Œdème, Fièvre.
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) : Cancer de la peau à l’exclusion du mélanome (y compris carcinome basocellulaire et carcinome malpighien spino-cellulaire), Tumeur bénigne
Infections et infestations : infections des voies respiratoires (y compris infections des voies respiratoires basses et infections des voies respiratoires hautes, pneumonie, sinusite, pharyngite, rhinopharyngite et pneumonie herpétique). Infections systémiques (y compris sepsis, candidose et grippe), infections intestinales (y compris gastroentérite virale), infections cutanées et des tissus mous (y compris panaris superficiel périunguéal, cellulite, impétigo, fasciite nécrosante et zona), infections de l’oreille, infections buccales (y compris herpès, herpès buccal et infections dentaires), infections des organes de reproduction (y compris mycose vulvo-vaginale), infections des voies urinaires (y compris pyélonéphrite), infections fongiques, infections articulaires.
Affections du système immunitaire : hypersensibilité et allergies
Affections gastro-intestinales : douleurs abdominales, nausées et vomissements.
Affections du système nerveux : céphalées, paresthésies (y compris hypoesthésie), migraine, compression des racines nerveuses.
Affections de la peau et du tissu sous-cutané : Rash cutané (et parfois éruption exfoliative), aggravation ou apparition d’un psoriasis (y compris psoriasis pustulaire palmoplantaire) 1), urticaire, ecchymoses (y compris purpura), dermatite (y compris eczéma), onychoclasie, hyperhidrose, alopécie), prurit
Affections musculo-squelettiques et systémiques : douleurs musculo-squelettiques, spasmes musculaires (y compris augmentation de la créatine phosphokinase sérique)
Affections hématologiques et du système lymphatique : leucopénie (y compris
neutropénie et agranulocytose), anémie, leucocytoose, thrombocytopénie
Affections hépatobiliaires : élévation des enzymes hépatiques, cholécystite et lithiase biliaire, stéatose hépatique, hyperbilirubinémie
Troubles du métabolisme et de la nutrition : augmentation du taux de lipides, hypokaliémie, augmentation de l’acide urique, taux anormal de sodium dans le sang, hypocalcémie, hyperglycémie, hypophosphatémie, déshydratation.
Affections psychiatriques : troubles de l’humeur (y compris dépression), anxiété, insomnie.
Affections oculaires : troubles visuels, conjonctivite, blépharite, gonflement des yeux
Affections de l’oreille et du labyrinthe : vertiges
Affections cardiaques : tachycardie
Affections vasculaires : hypertension, bouffées de chaleur, hématomes
Affections respiratoires, thoraciques et médiastinales : asthme, dyspnée, toux
Affections du rein et des voies urinaires : insuffisance rénale, hématurie
Investigations : troubles de la coagulation et troubles hémorragiques (incluant un allongement du temps de céphaline activé), positivité aux auto-anticorps (y compris aux anticorps anti-ADN double brin), augmentation du taux sanguin de lactate deshydrogénase.
Lésions, intoxications et complications liées aux procédures : mauvaise cicatrisation
Autres : se reporter au RCP
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) : Cancer de la peau à l’exclusion du mélanome (y compris carcinome basocellulaire et carcinome malpighien spino-cellulaire), Tumeur bénigne
Infections et infestations : infections des voies respiratoires (y compris infections des voies respiratoires basses et infections des voies respiratoires hautes, pneumonie, sinusite, pharyngite, rhinopharyngite et pneumonie herpétique). Infections systémiques (y compris sepsis, candidose et grippe), infections intestinales (y compris gastroentérite virale), infections cutanées et des tissus mous (y compris panaris superficiel périunguéal, cellulite, impétigo, fasciite nécrosante et zona), infections de l’oreille, infections buccales (y compris herpès, herpès buccal et infections dentaires), infections des organes de reproduction (y compris mycose vulvo-vaginale), infections des voies urinaires (y compris pyélonéphrite), infections fongiques, infections articulaires.
Affections du système immunitaire : hypersensibilité et allergies
Affections gastro-intestinales : douleurs abdominales, nausées et vomissements.
Affections du système nerveux : céphalées, paresthésies (y compris hypoesthésie), migraine, compression des racines nerveuses.
Affections de la peau et du tissu sous-cutané : Rash cutané (et parfois éruption exfoliative), aggravation ou apparition d’un psoriasis (y compris psoriasis pustulaire palmoplantaire) 1), urticaire, ecchymoses (y compris purpura), dermatite (y compris eczéma), onychoclasie, hyperhidrose, alopécie), prurit
Affections musculo-squelettiques et systémiques : douleurs musculo-squelettiques, spasmes musculaires (y compris augmentation de la créatine phosphokinase sérique)
Affections hématologiques et du système lymphatique : leucopénie (y compris
neutropénie et agranulocytose), anémie, leucocytoose, thrombocytopénie
Affections hépatobiliaires : élévation des enzymes hépatiques, cholécystite et lithiase biliaire, stéatose hépatique, hyperbilirubinémie
Troubles du métabolisme et de la nutrition : augmentation du taux de lipides, hypokaliémie, augmentation de l’acide urique, taux anormal de sodium dans le sang, hypocalcémie, hyperglycémie, hypophosphatémie, déshydratation.
Affections psychiatriques : troubles de l’humeur (y compris dépression), anxiété, insomnie.
Affections oculaires : troubles visuels, conjonctivite, blépharite, gonflement des yeux
Affections de l’oreille et du labyrinthe : vertiges
Affections cardiaques : tachycardie
Affections vasculaires : hypertension, bouffées de chaleur, hématomes
Affections respiratoires, thoraciques et médiastinales : asthme, dyspnée, toux
Affections du rein et des voies urinaires : insuffisance rénale, hématurie
Investigations : troubles de la coagulation et troubles hémorragiques (incluant un allongement du temps de céphaline activé), positivité aux auto-anticorps (y compris aux anticorps anti-ADN double brin), augmentation du taux sanguin de lactate deshydrogénase.
Lésions, intoxications et complications liées aux procédures : mauvaise cicatrisation
Autres : se reporter au RCP
Conduite à tenir en cas d'effets indésirables
Réactions allergiques
Si le patient a des réactions allergiques avec des symptômes tels qu’oppression dans la poitrine, respiration sifflante, sensations vertigineuses, gonflement ou éruption cutanée, arrêter les injections d'HUKYNDRA® et contacter son médecin immédiatement car dans de rares cas, ces réactions peuvent menacer le pronostic vital.
Infections
Le patient peut développer plus facilement des infections au cours du traitement par HUKYNDRA®. Ce risque peut augmenter s'il a des problèmes au niveau des poumons. Ces infections peuvent être graves et elles incluent : tuberculose, infections causées par des virus, des champignons, des parasites ou des bactéries, infection sévère du sang (septicémie). Dans de rares cas, ces infections peuvent menacer la vie du patient.
Il est important de prévenir le médecin si le patient a des symptômes tels que de la fièvre, s'il a des plaies, s'il se sent fatigué ou s'il a des problèmes dentaires. Le médecin dira au patient d’arrêter son traitement par HUKYNDRA® pendant un certain temps.
Tuberculose
Si des symptômes de tuberculose (par exemple, toux qui ne part pas, perte de poids, manque d’énergie, légère fièvre) ou si d’autres infections apparaissent durant ou après le traitement, prévenir le médecin immédiatement.
Maladie démyélinisante
Informer immédiatement le médecin si le patient présente des symptômes tels que des modifications de la vision, une faiblesse dans les bras ou les jambes, ou un engourdissement ou des fourmillements dans une partie du corps.
Troubles cardiaques
Si le patient développe de nouveaux symptômes ou si ceux de l’insuffisance cardiaque s’aggravent (par exemple souffle court ou gonflement des pieds), il doit contacter immédiatement son médecin.
Fièvre, contusions, saignements ou pâleur
Chez certains patients, l'organisme peut ne pas parvenir à fabriquer assez de cellules sanguines qui aident votre organisme à lutter contre les infections ou à arrêter les hémorragies. Si le patient présente une fièvre qui ne disparaît pas, s'il a des contusions ou saigne très facilement, s'il présente une pâleur, contacter tout de suite le médecin. Le médecin pourrait décider d'arrêter le traitement.
Cancer
Si de nouvelles lésions cutanées apparaissent pendant ou après le traitement ou si des lésions pré-existantes changent d’aspect, le patient doit le signaler à son médecin.
Maladie auto-immune
Dans de rares cas, le traitement par HUKYNDRA® peut entraîner un syndrome de type lupus. Contacter le médecin si des symptômes tels que rash persistant inexpliqué, fièvre, douleur articulaire ou fatigue surviennent.
Informer le médecin dès que possible si le patient constate un des effets suivants : des signes d’infection tels que fièvre, sensations de nausées ou de malaise, plaies, problèmes dentaires, brûlures en urinant, une sensation de faiblesse ou de fatigue, une toux, des fourmillements, un engourdissement, une vision double, une faiblesse des bras ou des jambes, un « bouton » ou une plaie ouverte qui ne cicatrise pas, signes et symptômes évocateurs de troubles sanguins tels que fièvre persistante, contusions, saignements, pâleur.
Si le patient a des réactions allergiques avec des symptômes tels qu’oppression dans la poitrine, respiration sifflante, sensations vertigineuses, gonflement ou éruption cutanée, arrêter les injections d'HUKYNDRA® et contacter son médecin immédiatement car dans de rares cas, ces réactions peuvent menacer le pronostic vital.
Infections
Le patient peut développer plus facilement des infections au cours du traitement par HUKYNDRA®. Ce risque peut augmenter s'il a des problèmes au niveau des poumons. Ces infections peuvent être graves et elles incluent : tuberculose, infections causées par des virus, des champignons, des parasites ou des bactéries, infection sévère du sang (septicémie). Dans de rares cas, ces infections peuvent menacer la vie du patient.
Il est important de prévenir le médecin si le patient a des symptômes tels que de la fièvre, s'il a des plaies, s'il se sent fatigué ou s'il a des problèmes dentaires. Le médecin dira au patient d’arrêter son traitement par HUKYNDRA® pendant un certain temps.
Tuberculose
Si des symptômes de tuberculose (par exemple, toux qui ne part pas, perte de poids, manque d’énergie, légère fièvre) ou si d’autres infections apparaissent durant ou après le traitement, prévenir le médecin immédiatement.
Maladie démyélinisante
Informer immédiatement le médecin si le patient présente des symptômes tels que des modifications de la vision, une faiblesse dans les bras ou les jambes, ou un engourdissement ou des fourmillements dans une partie du corps.
Troubles cardiaques
Si le patient développe de nouveaux symptômes ou si ceux de l’insuffisance cardiaque s’aggravent (par exemple souffle court ou gonflement des pieds), il doit contacter immédiatement son médecin.
Fièvre, contusions, saignements ou pâleur
Chez certains patients, l'organisme peut ne pas parvenir à fabriquer assez de cellules sanguines qui aident votre organisme à lutter contre les infections ou à arrêter les hémorragies. Si le patient présente une fièvre qui ne disparaît pas, s'il a des contusions ou saigne très facilement, s'il présente une pâleur, contacter tout de suite le médecin. Le médecin pourrait décider d'arrêter le traitement.
Cancer
Si de nouvelles lésions cutanées apparaissent pendant ou après le traitement ou si des lésions pré-existantes changent d’aspect, le patient doit le signaler à son médecin.
Maladie auto-immune
Dans de rares cas, le traitement par HUKYNDRA® peut entraîner un syndrome de type lupus. Contacter le médecin si des symptômes tels que rash persistant inexpliqué, fièvre, douleur articulaire ou fatigue surviennent.
Informer le médecin dès que possible si le patient constate un des effets suivants : des signes d’infection tels que fièvre, sensations de nausées ou de malaise, plaies, problèmes dentaires, brûlures en urinant, une sensation de faiblesse ou de fatigue, une toux, des fourmillements, un engourdissement, une vision double, une faiblesse des bras ou des jambes, un « bouton » ou une plaie ouverte qui ne cicatrise pas, signes et symptômes évocateurs de troubles sanguins tels que fièvre persistante, contusions, saignements, pâleur.
Conduite à tenir en cas d'oubli de dose
Si oubli ≤ 7 jours : l'injection doit être réalisée dès que possible, puis les injections suivantes doivent rester programmées aux dates initialement prévues.
Si oubli > 7 jours : l'injection doit être réalisée dès que possible, puis l'injection suivante doit être décalée de façon à respecter un intervalle de 14 jours.
Si oubli > 7 jours : l'injection doit être réalisée dès que possible, puis l'injection suivante doit être décalée de façon à respecter un intervalle de 14 jours.
En cas de surdosage
Aucune toxicité liée à la dose n’a été observée dans les études cliniques. Il y a peu de risque pour le patient.
Il est cependant conseillé de contacter son médecin ou son pharmacien, afin de lui exposer la situation. Le patient doit prendre l'habitude de toujours garder avec lui la boîte du médicament, même si elle est vide.
Il est cependant conseillé de contacter son médecin ou son pharmacien, afin de lui exposer la situation. Le patient doit prendre l'habitude de toujours garder avec lui la boîte du médicament, même si elle est vide.
En cas d'arrêt du traitement
La décision d’arrêter d’utiliser HUKYNDRA® doit être discutée avec le médecin. Les symptômes peuvent revenir à l’arrêt du traitement.
Situations particulières
Vaccination
Ce médicament pouvant modifier l’immunité, des recommandations vaccinales spécifiques s’appliquent afin de réduire le risque d’infections graves ; il convient de se référer au calendrier vaccinal en vigueur. Les vaccins vivants atténués (ROR, BCG, vaccins contre les infections à rotavirus, la varicelle, la fièvre jaune, la dengue) sont contre-indiqués en cas d'immunodépression congénitale ou acquise tant que l'immunodépression persiste, sauf cas particuliers. La vaccination de l’entourage et des professionnels de santé en contact étroit est également recommandée afin de limiter la transmission d’infections et d’assurer une protection indirecte.
Tuberculose
Avant l’instauration du traitement par HUKYNDRA®, tous les patients doivent faire l’objet d’une recherche d’infection tuberculeuse active ou non (« latente »).
Réactivation d’hépatite B
Une réactivation d’hépatite B s’est produite chez des patients qui ont reçu un antagoniste du TNF y compris HUKYNDRA® et qui étaient porteurs chroniques de ce virus (c’est-à-dire antigène de surface positifAg HBs positif). Certains cas ont eu une issue fatale. Les patients doivent faire l’objet d’un dépistage d’infection à VHB avant l’initiation d’un traitement par HUKYNDRA®.
Chirurgie
Un patient traité par HUKYNDRA® nécessitant une intervention chirurgicale doit être attentivement surveillé afin de dépister des infections et des actions appropriées doivent être entreprises.
Sujets âgés
Une attention particulière concernant le risque d’infection doit être apportée lors du traitement des sujets âgés.
Interventions chirurgicales ou dentaires : les professionnels de santé (anesthésistes et chirurgiens) doivent être averti du traitement par HUKYNDRA®. Un arrêt doit être envisagé selon l’acte chirurgical.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par 0,4 ml, c.-à-d. qu’il est essentiellement « sans sodium ».
HUKYNDRA® solution injectable en seringue préremplie
Ce médicament contient 0,4 mg de polysorbate 80 dans chaque seringue pré-remplie équivalent à 1 mg/ml. Les polysorbates peuvent provoquer des réactions allergiques.
HUKYNDRA® solution injectable en stylo prérempli
Ce médicament contient 0,4 mg de polysorbate 80 dans chaque seringue pré-remplie équivalent à 1 mg/ml. Les polysorbates peuvent provoquer des réactions allergiques
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
HUKYNDRA® peut avoir une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines. Des vertiges et des troubles visuels peuvent survenir après l’administration d’HUKYNDRA®.
Ce médicament pouvant modifier l’immunité, des recommandations vaccinales spécifiques s’appliquent afin de réduire le risque d’infections graves ; il convient de se référer au calendrier vaccinal en vigueur. Les vaccins vivants atténués (ROR, BCG, vaccins contre les infections à rotavirus, la varicelle, la fièvre jaune, la dengue) sont contre-indiqués en cas d'immunodépression congénitale ou acquise tant que l'immunodépression persiste, sauf cas particuliers. La vaccination de l’entourage et des professionnels de santé en contact étroit est également recommandée afin de limiter la transmission d’infections et d’assurer une protection indirecte.
Tuberculose
Avant l’instauration du traitement par HUKYNDRA®, tous les patients doivent faire l’objet d’une recherche d’infection tuberculeuse active ou non (« latente »).
Réactivation d’hépatite B
Une réactivation d’hépatite B s’est produite chez des patients qui ont reçu un antagoniste du TNF y compris HUKYNDRA® et qui étaient porteurs chroniques de ce virus (c’est-à-dire antigène de surface positifAg HBs positif). Certains cas ont eu une issue fatale. Les patients doivent faire l’objet d’un dépistage d’infection à VHB avant l’initiation d’un traitement par HUKYNDRA®.
Chirurgie
Un patient traité par HUKYNDRA® nécessitant une intervention chirurgicale doit être attentivement surveillé afin de dépister des infections et des actions appropriées doivent être entreprises.
Sujets âgés
Une attention particulière concernant le risque d’infection doit être apportée lors du traitement des sujets âgés.
Interventions chirurgicales ou dentaires : les professionnels de santé (anesthésistes et chirurgiens) doivent être averti du traitement par HUKYNDRA®. Un arrêt doit être envisagé selon l’acte chirurgical.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par 0,4 ml, c.-à-d. qu’il est essentiellement « sans sodium ».
HUKYNDRA® solution injectable en seringue préremplie
Ce médicament contient 0,4 mg de polysorbate 80 dans chaque seringue pré-remplie équivalent à 1 mg/ml. Les polysorbates peuvent provoquer des réactions allergiques.
HUKYNDRA® solution injectable en stylo prérempli
Ce médicament contient 0,4 mg de polysorbate 80 dans chaque seringue pré-remplie équivalent à 1 mg/ml. Les polysorbates peuvent provoquer des réactions allergiques
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
HUKYNDRA® peut avoir une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines. Des vertiges et des troubles visuels peuvent survenir après l’administration d’HUKYNDRA®.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients
Tuberculose évolutive ou autres infections sévères (sepsis et infections opportunistes)
Insuffisance cardiaque modérée à sévère (NYHA classes III/IV)
Tuberculose évolutive ou autres infections sévères (sepsis et infections opportunistes)
Insuffisance cardiaque modérée à sévère (NYHA classes III/IV)
Grossesse et allaitement
Source
Grossesse
Allaitement
Au vu des données disponibles sur l’adalimumab et allaitement, son utilisation est possible chez une femme qui allaite.
Exposition paternelle
- En prévision d’une grossesse / En préconceptionnel
- Une consultation préconceptionnelle est souhaitable afin de faire le point sur la pathologie et son traitement en vue d’une future grossesse.
- S’il s’avère nécessaire, l’adalimumab peut être poursuivi dans la perspective d’une grossesse.
- Découverte d’une grossesse pendant le traitement
- Rassurer la patiente quant au risque malformatif de l’adalimumab.
- Si après avis du prescripteur, l’adalimumab est nécessaire à l’équilibre maternel, voir ci dessous « Traiter une femme enceinte ».
- Traiter une femme enceinte
- Si après avis du prescripteur, l’adalimumab est nécessaire à l’équilibre maternel, il peut être utilisé chez une femme enceinte, en programmant dans la mesure du possible une dernière administration au début du 3ème trimestre, ce qui permet une élimination du produit avant l’accouchement
- En raison de l’immunosuppression maternelle induite par le traitement, tenir compte d’un risque potentiellement accru d’infection en cours de grossesse (listériose, CMV, toxoplasmose…), ce d’autant que le traitement peut masquer la fièvre.
- Malgré l’absence d’effet rapporté dans la littérature récente sur un effectif important d’enfants exposés à l’adalimumab au 3ème trimestre de la grossesse (Cf. Etat des connaissances),et par analogie avec un autre anti TNF-α de même structure (infliximab), les mesures d’hygiène usuelles restent justifiées afin d’éviter des infections chez les enfants dans les 6 mois qui suivent la dernière injection maternelle.
- Pour les vaccins chez l’enfant, voir ci-dessous.
- Vaccination des enfants de mère traitée
- vaccins inertes (inactivés) : il n’y a pas lieu de retarder la vaccination de l’enfant.
- vaccins vivants (BCG, rotavirus..) : le protocole vaccinal doit tenir compte du délai depuis la dernière injection maternelle. Au besoin, il peut être utile de réaliser un dosage plasmatique de l’adalimumab chez l’enfant afin de s’assurer qu’il ait bien éliminé le médicament.
Allaitement
Au vu des données disponibles sur l’adalimumab et allaitement, son utilisation est possible chez une femme qui allaite.
Exposition paternelle
- En prévision d’une grossesse / En préconceptionnel
- L’adalimumab peut être poursuivi chez un homme traité qui désire concevoir.
- Grossesse conçue sous traitement paternel
- Rassurer le couple quant aux conséquences du traitement paternel par adalimumab sur le futur enfant.
- Traitement paternel en cours de grossesse
- L’adalimumab peut être débuté/poursuivi chez un futur père et aucun suivi de la grossesse différent de la surveillance usuelle n’est à envisager.
Conditions de prescription et de délivrance
Source MeddisparMédicament d'exception à prescription réservée à certains spécialistes
- aux spécialistes et services DERMATOLOGIE
- aux spécialistes et services HEPATO/GASTRO-ENTEROLOGIE
- aux spécialistes et services MÉDECINE INTERNE
- aux spécialistes et services OPHTALMOLOGIE
- aux spécialistes et services PÉDIATRIE
- aux spécialistes et services RHUMATOLOGIE
Le prescripteur informe le patient de la possibilité de substitution par le pharmacien du médicament biologique prescrit.
En cas de substitution, le pharmacien:
- Informe le patient lors de la dispensation de la substitution effective et des informations utiles associées, dont le rappel des règles de conservation de la spécialité dispensée.
- Informe le prescripteur quant au médicament dispensé.
- Procède à l'enregistrement du nom du médicament délivré par substitution et son numéro de lot par tous moyens adaptés afin de mettre en œuvre la traçabilité requise pour tous les médicaments biologiques.
- Assure la continuité de la dispensation du même médicament lors des dispensations suivantes.
Durée maximale de prescription : 1 an
Informations médicales
Service d’information médicale EG labo (Laboratoires EuroGenerics) :
- Par téléphone : 01 46 94 86 86 (du lundi au vendredi de 9h à 18h), 01 81 79 31 30 (de 18h à 9h et le week-end).
- Par Email : contact@eglabo.fr
Commande
Auprès de votre grossiste répartiteur.
Directement auprès de EG labo (Laboratoires EuroGenerics) : 01 46 94 86 86 (du lundi au vendredi de 9h à 18h), 01 81 79 31 30 (de 18h à 9h et le week-end).
Directement auprès de EG labo (Laboratoires EuroGenerics) : 01 46 94 86 86 (du lundi au vendredi de 9h à 18h), 01 81 79 31 30 (de 18h à 9h et le week-end).
Modalités de conservation
Durée de conservation
Seringue préremplie : 4 ans
Stylo prérempli : 3 ans
Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Conserver la seringue préremplie dans l’emballage extérieur à l’abri de la lumière.
Une seringue préremplie ou un stylo prérempli peut être conservé à des températures allant jusqu’à 25 °C pendant 30 jours maximum. La seringue préremplie ou le stylo prérempli doit être conservé à l’abri de la lumière, et jeté s’il n’est pas utilisé pendant cette période de 30 jours.
Tenir hors de la vue et de la portée des enfants.
Seringue préremplie : 4 ans
Stylo prérempli : 3 ans
Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Conserver la seringue préremplie dans l’emballage extérieur à l’abri de la lumière.
Une seringue préremplie ou un stylo prérempli peut être conservé à des températures allant jusqu’à 25 °C pendant 30 jours maximum. La seringue préremplie ou le stylo prérempli doit être conservé à l’abri de la lumière, et jeté s’il n’est pas utilisé pendant cette période de 30 jours.
Tenir hors de la vue et de la portée des enfants.