ROACTEMRA®
Référence| DCI | Tocilizumab |
| ATC | L04AC07 |
| CLASSE | Immunosuppresseurs, Inhibiteur IL-6 |
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant.
Indications thérapeutiques
ROACTEMRA® est indiqué pour le traitement des patients adultes atteints d’artérite à cellules géantes (ACG).
ROACTEMRA® est indiqué pour le traitement des patients adultes atteints d’artérite à cellules géantes (ACG).
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée
162 mg une fois par semaine, administrée par voie sous-cutanée, en association à une corticothérapie dégressive.
ROACTEMRA® peut être utilisé seul après l’arrêt des corticoïdes.
ROACTEMRA ne doit pas être utilisé en monothérapie pour traiter une rechute aiguë
Compte tenu de la nature chronique de l’ACG, le traitement au-delà de 52 semaines doit être déterminé selon l'activité de la maladie, le jugement médical et le choix du patient.
Adaptations posologiques en cas d’anomalies des paramètres biologiques : cf RCP
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée
162 mg une fois par semaine, administrée par voie sous-cutanée, en association à une corticothérapie dégressive.
ROACTEMRA® peut être utilisé seul après l’arrêt des corticoïdes.
ROACTEMRA ne doit pas être utilisé en monothérapie pour traiter une rechute aiguë
Compte tenu de la nature chronique de l’ACG, le traitement au-delà de 52 semaines doit être déterminé selon l'activité de la maladie, le jugement médical et le choix du patient.
Adaptations posologiques en cas d’anomalies des paramètres biologiques : cf RCP
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant.
Présentations et dosages
ROACTEMRA® 162 mg - solution injectable en seringue préremplie - Boite de 4.
ROACTEMRA® 162 mg - solution injectable en stylo prérempli - Boite de 4.
ROACTEMRA® 162 mg - solution injectable en stylo prérempli - Boite de 4.
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Traitement de l'AJIs
Posologie recommandée chez l'enfant âgé de plus de 1 an
Patients dont le poids est > à 30 kg : 162 mg une fois toutes les semaines
Patients dont le poids < à 30 kg et > 10 kg : 162 mg une fois toutes les deux semaines
Traitement de l'AJIp
Posologie recommandée chez l'enfant âgé de plus de 2 ans
Patients dont le poids est > à 30 kg : 162 mg une fois toutes les deux semaines
Patients dont le poids est < à 30 kg : 162 mg une fois toutes les trois semaines
Indications thérapeutiques
ROACTEMRA® est indiqué pour le traitement de l’arthrite juvénile idiopathique systémique (AJIs) active chez les patients âgés de 1 ans et plus, qui ont présenté une réponse inadéquate à un précédent traitement par AINS et corticoïdes systémiques. RoActemra peut être utilisé en monothérapie (en cas d’intolérance au MTX ou lorsque le traitement par MTX est inadapté) ou en association au MTX.
ROACTEMRA® en association au méthotrexate (MTX) est indiqué pour le traitement de l’arthrite juvénile idiopathique polyarticulaire (AJIp : facteur rhumatoïde positif ou négatif et oligoarthrite étendue) chez les patients âgés de 2 ans et plus, qui ont présenté une réponse inadéquate à un précédent traitement par MTX.
ROACTEMRA® peut être utilisé en monothérapie en cas d’intolérance au MTX, ou lorsque la poursuite du traitement par MTX est inadaptée.
ROACTEMRA® est indiqué pour le traitement de l’arthrite juvénile idiopathique systémique (AJIs) active chez les patients âgés de 1 ans et plus, qui ont présenté une réponse inadéquate à un précédent traitement par AINS et corticoïdes systémiques. RoActemra peut être utilisé en monothérapie (en cas d’intolérance au MTX ou lorsque le traitement par MTX est inadapté) ou en association au MTX.
ROACTEMRA® en association au méthotrexate (MTX) est indiqué pour le traitement de l’arthrite juvénile idiopathique polyarticulaire (AJIp : facteur rhumatoïde positif ou négatif et oligoarthrite étendue) chez les patients âgés de 2 ans et plus, qui ont présenté une réponse inadéquate à un précédent traitement par MTX.
ROACTEMRA® peut être utilisé en monothérapie en cas d’intolérance au MTX, ou lorsque la poursuite du traitement par MTX est inadaptée.
Population adulte
Pas d'indication chez l'adulte
Pas d'indication chez l'adulte
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Traitement de l'AJIs
Posologie recommandée chez l'enfant âgé de plus de 1 an
Patients dont le poids est > à 30 kg : 162 mg une fois toutes les semaines
Patients dont le poids < à 30 kg et > 10 kg : 162 mg une fois toutes les deux semaines
Traitement de l'AJIp
Posologie recommandée chez l'enfant âgé de plus de 2 ans
Patients dont le poids est > à 30 kg : 162 mg une fois toutes les deux semaines
Patients dont le poids est < à 30 kg : 162 mg une fois toutes les trois semaines
Présentations et dosages
ROACTEMRA® 162 mg - solution injectable en seringue préremplie - Boite de 4.
ROACTEMRA® 162 mg - solution injectable en stylo prérempli - Boite de 4.
ROACTEMRA® 162 mg - solution injectable en stylo prérempli - Boite de 4.
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- ORENCIA® (Abatacept)
- SIMPONI® (Golimumab)
- YUFLYMA® (Adalimumab)
- AMSPARITY® (Adalimumab)
- HUKYNDRA® (Adalimumab)
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant
Indications thérapeutiques
ROACTEMRA®, en association au méthotrexate (MTX), est indiqué pour :
- le traitement de la polyarthrite rhumatoïde (PR) active, sévère et évolutive chez les patients adultes non précédemment traités par MTX
- le traitement de la PR active, modérée à sévère, chez les patients adultes qui ont présenté soit une réponse inadéquate, soit une intolérance à un précédent traitement par un ou plusieurs traitements de fond (DMARDs) ou par un ou plusieurs antagonistes du facteur de nécrose tumorale (anti-TNF).
Chez ces patients, RoActemra peut être utilisé en monothérapie en cas d’intolérance au MTX, ou lorsque la poursuite du traitement par MTX est inadaptée.
ROACTEMRA®, en association au méthotrexate (MTX), est indiqué pour :
- le traitement de la polyarthrite rhumatoïde (PR) active, sévère et évolutive chez les patients adultes non précédemment traités par MTX
- le traitement de la PR active, modérée à sévère, chez les patients adultes qui ont présenté soit une réponse inadéquate, soit une intolérance à un précédent traitement par un ou plusieurs traitements de fond (DMARDs) ou par un ou plusieurs antagonistes du facteur de nécrose tumorale (anti-TNF).
Chez ces patients, RoActemra peut être utilisé en monothérapie en cas d’intolérance au MTX, ou lorsque la poursuite du traitement par MTX est inadaptée.
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée
162 mg une fois par semaine
Les informations disponibles sont limitées quant au passage de la formulation intraveineuse de ROACTEMRA® à la formulation sous-cutanée à dose fixe de ROACTEMRA®. La fréquence d’administration d’une fois par semaine doit être respectée.
Les patients passant de la formulation intraveineuse à la formulation sous-cutanée doivent recevoir leur première administration sous-cutanée à la date prévue de la prochaine dose intraveineuse, sous la supervision d’un professionnel de santé qualifié.
Adaptations posologiques en cas d’anomalies des paramètres biologiques : cf RCP
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée
162 mg une fois par semaine
Les informations disponibles sont limitées quant au passage de la formulation intraveineuse de ROACTEMRA® à la formulation sous-cutanée à dose fixe de ROACTEMRA®. La fréquence d’administration d’une fois par semaine doit être respectée.
Les patients passant de la formulation intraveineuse à la formulation sous-cutanée doivent recevoir leur première administration sous-cutanée à la date prévue de la prochaine dose intraveineuse, sous la supervision d’un professionnel de santé qualifié.
Adaptations posologiques en cas d’anomalies des paramètres biologiques : cf RCP
 Posologie population pédiatrique
Posologie population pédiatrique
Pas d'indication chez l'enfant
Présentations et dosages
ROACTEMRA® 162 mg - solution injectable en seringue préremplie - Boite de 4.
ROACTEMRA® 162 mg - solution injectable en stylo prérempli - Boite de 4.
ROACTEMRA® 162 mg - solution injectable en stylo prérempli - Boite de 4.
Médicaments liés à cette pathologie
- HUMIRA® (Adalimumab)
- AMGEVITA® (Adalimumab)
- HULIO® (Adalimumab)
- ENBREL® (Etanercept)
- BENEPALI® (Etanercept)
- ERELZI® (Etanercept)
- NEPEXTO® (Etanercept)
- KINERET® (Anakinra)
- HYRIMOZ® (Adalimumab)
- IMRALDI® (Adalimumab)
- IDACIO® (Adalimumab)
- CIMZIA® (Certolizumab pegol)
- KEVZARA® (Sarilumab)
- ORENCIA® (Abatacept)
- SIMPONI® (Golimumab)
- YUFLYMA® (Adalimumab)
- REMSIMA® (Infliximab)
- AMSPARITY® (Adalimumab)
- HUKYNDRA® (Adalimumab)
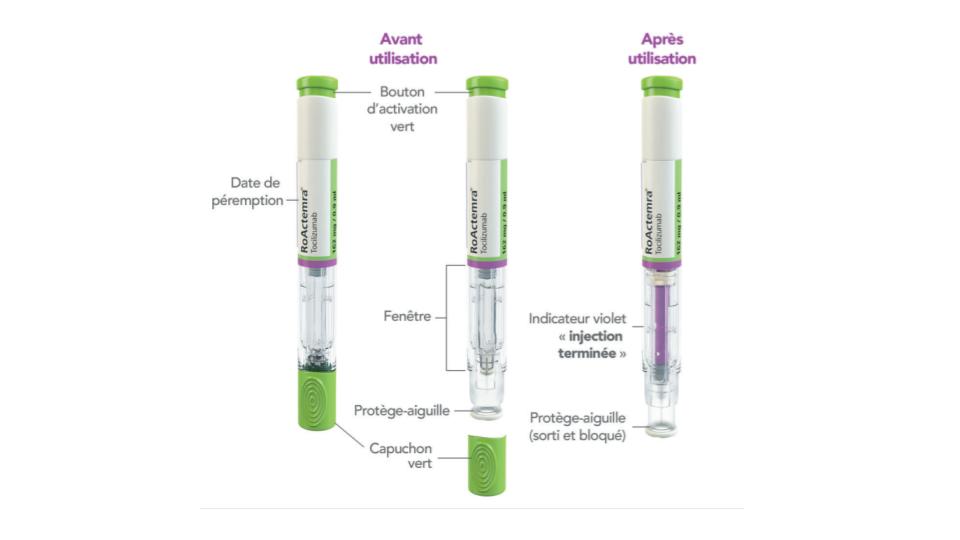
Mode d'administration
Solution injectable en seringue ou stylo prérempli à administrer par voie sous-cutanée.
Le traitement doit être instauré par des professionnels de santé expérimentés dans le diagnostic et le traitement de la PR, de l’AJIs, de l’AJIp et/ou de l’ACG et la première injection effectuée sous la supervision d'un professionnel de santé qualifié. Après une formation appropriée à la technique d'injection sous-cutanée et si le médecin le considère apte à le faire, le patients peut s'auto-injecter ROACTEMRA®.
Le stylo prérempli ne doit pas être utilisé chez les enfants de moins de 12 ans en raison du risque potentiel d'injection intramusculaire due à la minceur de la couche de tissu sous-cutané.
1 - Sortir le produit du réfrigérateur, le poser sur une surface plane puis laisser le produit revenir à température ambiante (18°C à 28°C) avant de procéder à l'injection : entre 25 et 30 min pour la seringue et jusqu'à 45 min pour le stylo.
2 - Ne pas secouer le produit . Pour éviter que le médicament ne se dessèche et ne bloque l’aiguille ou le piston, débuter l'injection dans les 5 min (pour la seringue préremplie) ou 3 min (pour le stylo prérempli) après avoir enlevé le capuchon.
3 - Se laver les mains avec du savon et de l'eau avant l’injection et nettoyer le site d'injection choisi en utilisant le tampon alcoolisé afin de réduire le risque d'infection.
4 - Injection du médicament.
5 - Après utilisation, placer le stylo pré-rempli dans un collecteur adapté et à ramener à la pharmacie. Le récipient ne doit pas être recyclé.
Le traitement doit être instauré par des professionnels de santé expérimentés dans le diagnostic et le traitement de la PR, de l’AJIs, de l’AJIp et/ou de l’ACG et la première injection effectuée sous la supervision d'un professionnel de santé qualifié. Après une formation appropriée à la technique d'injection sous-cutanée et si le médecin le considère apte à le faire, le patients peut s'auto-injecter ROACTEMRA®.
Le stylo prérempli ne doit pas être utilisé chez les enfants de moins de 12 ans en raison du risque potentiel d'injection intramusculaire due à la minceur de la couche de tissu sous-cutané.
1 - Sortir le produit du réfrigérateur, le poser sur une surface plane puis laisser le produit revenir à température ambiante (18°C à 28°C) avant de procéder à l'injection : entre 25 et 30 min pour la seringue et jusqu'à 45 min pour le stylo.
2 - Ne pas secouer le produit . Pour éviter que le médicament ne se dessèche et ne bloque l’aiguille ou le piston, débuter l'injection dans les 5 min (pour la seringue préremplie) ou 3 min (pour le stylo prérempli) après avoir enlevé le capuchon.
3 - Se laver les mains avec du savon et de l'eau avant l’injection et nettoyer le site d'injection choisi en utilisant le tampon alcoolisé afin de réduire le risque d'infection.
4 - Injection du médicament.
- Les sites d'injection recommandés sont l'avant et le milieu des cuisses et la partie inférieure de l'abdomen, au-dessous du nombril, à l'exception de la zone de 5 cm qui entoure directement le nombril. Si un professionnel de santé réalise l'injection, la face externe des bras peut également être utilisée.
- Choisir un endroit différent à chaque injection, à 2,5/3 cm au moins de la zone que vous avez utilisée pour l'injection précédente.
- Eviter les endroits qui pourraient être irrités par une ceinture.
- Ne pas injecter dans un grain de beauté, une cicatrice, un bleu ou dans une région où la peau est sensible, rouge, dure ou abîmée.
5 - Après utilisation, placer le stylo pré-rempli dans un collecteur adapté et à ramener à la pharmacie. Le récipient ne doit pas être recyclé.
Effets indésirables les plus fréquents
Affections hématologiques et du système lymphatique : leucopénie, neutropénie, hypofibrinogénémie
Affections oculaires : conjonctivite
Affections gastro-intestinales : douleur abdominale, ulcération buccale, gastrite
Troubles généraux et anomalies au site d’administration : OEdème périphérique, réactions d’hypersensibilité
Infections et infestations : Infections des voies respiratoires supérieures, cellulite, pneumonie, herpès labial, zona
Investigations : augmentation des transaminases hépatiques, prise de poids, augmentation de la bilirubine totale
Troubles du métabolisme et de la nutrition : Hypercholestérolémie
Affections du système nerveux : céphalées, sensations vertigineuse
Troubles respiratoires, thoraciques et médiastinaux : toux, dyspnée
Affections de la peau et du tissu sous-cutané : rash, prurit, urticaire
Affections vasculaires : hypertension
Autres : se reporter au RCP
Affections oculaires : conjonctivite
Affections gastro-intestinales : douleur abdominale, ulcération buccale, gastrite
Troubles généraux et anomalies au site d’administration : OEdème périphérique, réactions d’hypersensibilité
Infections et infestations : Infections des voies respiratoires supérieures, cellulite, pneumonie, herpès labial, zona
Investigations : augmentation des transaminases hépatiques, prise de poids, augmentation de la bilirubine totale
Troubles du métabolisme et de la nutrition : Hypercholestérolémie
Affections du système nerveux : céphalées, sensations vertigineuse
Troubles respiratoires, thoraciques et médiastinaux : toux, dyspnée
Affections de la peau et du tissu sous-cutané : rash, prurit, urticaire
Affections vasculaires : hypertension
Autres : se reporter au RCP
Conduite à tenir en cas d'effets indésirables
Réactions allergiques pendant ou après l’injection : difficultés respiratoires, oppression de la poitrine ou étourdissement, éruption cutanée, démangeaison, urticaires, gonflements des lèvres, de la langue ou du visage.
Ces effets sont fréquents et peuvent toucher jusqu’à 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, une consultation médicale d'urgence est requise.
Signes d’infections graves : douleurs, fièvre et frissons, vésicules dans la bouche ou sur la peau, toux, gêne/sensation d'oppression dans la poitrine, essoufflement, rougeur, sensation de chaleur, gonflement inhabituel de la peau ou des articulations, douleur/sensibilité dans l'abdomen et/ou modification du transit intestinal. Ces effets sont fréquents et peuvent toucher jusqu’à 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, une consultation médicale d'urgence est requise.
Signes et symptômes de toxicité hépatique : fatigue, douleur abdominale, jaunisse (coloration jaune de la peau ou des yeux). Ces effets peuvent toucher jusqu’à 1 patient sur 1 000. En cas de survenue de l'un des ces effets indésirables, une consultation médicale d'urgence est requise.
Effets indésirables très fréquents : infections des voies respiratoires supérieures, dont les symptômes habituels sont les suivants : une toux, une obstruction nasale, un écoulement nasal, une angine et des maux de tête, augmentation des taux de lipides (cholestérol) dans le sang, réactions au site d’injection. Ces effets peuvent toucher plus de 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, l'avis d'un preofessionnel de santé est requis.
Effets indésirables fréquents : infection pulmonaire (pneumonie), zona, bouton de fièvre (herpès labial), vésicules, infection cutanée (cellulite) parfois accompagnée de fièvre et de frissons, éruption cutanée et démangeaisons, urticaire, réactions allergiques (hypersensibilité), infection oculaire (conjonctivite), maux de tête, sensations vertigineuses, augmentation de la pression artérielle, plaies buccales, douleur de l’estomac, rétention d’eau (oedème) au niveau des jambes, prise de poids, toux, difficultés respiratoires, diminution du nombre de globules blancs observée dans les analyses sanguines (neutropénie, leucopénie), anomalies des tests de la fonction hépatique (augmentation des transaminases), augmentation de la bilirubine observée dans les analyses sanguines, diminution du fibrinogène observée dans les analyses sanguines (une protéine impliquée dans la coagulation du sang). Ces effets peuvent toucher jusqu'à 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, l'avis d'un preofessionnel de santé est requis.
Ces effets sont fréquents et peuvent toucher jusqu’à 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, une consultation médicale d'urgence est requise.
Signes d’infections graves : douleurs, fièvre et frissons, vésicules dans la bouche ou sur la peau, toux, gêne/sensation d'oppression dans la poitrine, essoufflement, rougeur, sensation de chaleur, gonflement inhabituel de la peau ou des articulations, douleur/sensibilité dans l'abdomen et/ou modification du transit intestinal. Ces effets sont fréquents et peuvent toucher jusqu’à 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, une consultation médicale d'urgence est requise.
Signes et symptômes de toxicité hépatique : fatigue, douleur abdominale, jaunisse (coloration jaune de la peau ou des yeux). Ces effets peuvent toucher jusqu’à 1 patient sur 1 000. En cas de survenue de l'un des ces effets indésirables, une consultation médicale d'urgence est requise.
Effets indésirables très fréquents : infections des voies respiratoires supérieures, dont les symptômes habituels sont les suivants : une toux, une obstruction nasale, un écoulement nasal, une angine et des maux de tête, augmentation des taux de lipides (cholestérol) dans le sang, réactions au site d’injection. Ces effets peuvent toucher plus de 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, l'avis d'un preofessionnel de santé est requis.
Effets indésirables fréquents : infection pulmonaire (pneumonie), zona, bouton de fièvre (herpès labial), vésicules, infection cutanée (cellulite) parfois accompagnée de fièvre et de frissons, éruption cutanée et démangeaisons, urticaire, réactions allergiques (hypersensibilité), infection oculaire (conjonctivite), maux de tête, sensations vertigineuses, augmentation de la pression artérielle, plaies buccales, douleur de l’estomac, rétention d’eau (oedème) au niveau des jambes, prise de poids, toux, difficultés respiratoires, diminution du nombre de globules blancs observée dans les analyses sanguines (neutropénie, leucopénie), anomalies des tests de la fonction hépatique (augmentation des transaminases), augmentation de la bilirubine observée dans les analyses sanguines, diminution du fibrinogène observée dans les analyses sanguines (une protéine impliquée dans la coagulation du sang). Ces effets peuvent toucher jusqu'à 1 patient sur 10. En cas de survenue de l'un des ces effets indésirables, l'avis d'un preofessionnel de santé est requis.
Conduite à tenir en cas d'oubli de dose
Si un adulte atteint de PR ou ACG ou un enfant / adolescent atteint d’AJIs manque ou oublie une dose :
Si un enfant ou un adolescent atteint d’AJIp manque ou oublie une dose :
- Oubli de l'injection hebdomadaire dans les 7 jours suivant la date initialement programmée : attendre la prochaine date programmée pour injecter la dose suivante.
- En cas d’injection toutes les 2 semaines, si oubli de l'injection dans les 7 jours suivant la date initialement programmée, injecter une dose dès que possible, puis poursuite des injections suivantes aux dates préalablement programmées.
- Si oubli d'une injection depuis plus de 7 jours : l'avis d'un professionnel de santé ets recommandé (médecin ou pharmacien).
Si un enfant ou un adolescent atteint d’AJIp manque ou oublie une dose :
- Oubliée dans les 7 jours suivant la date initialement programmée, injecter une dose dès quepossible, puis poursuite des injections suivantes aux dates préalablement programmées.
- Si oubli d'une injection depuis plus de 7 jours : l'avis d'un professionnel de santé ets recommandé (médecin ou pharmacien).
En cas de surdosage
Les données disponibles sur le surdosage de RoActemra sont limitées. Aucune réaction indésirable grave n’a été observée chez des volontaires sains ayant reçu des doses uniques allant jusqu’à 28 mg/kg, bien qu’une neutropénie limitant la dose ait été observée.
Dans la mesure où ROACTEMRA® est administré à l’aide d’une seringue préremplie ou d'un stylo prérempli, il est peu probable de recevoir une dose excessive.
En cas de surdosage, contacter un professionnel de santé (médecin, pharmacien ou infirmier/ère).
Dans la mesure où ROACTEMRA® est administré à l’aide d’une seringue préremplie ou d'un stylo prérempli, il est peu probable de recevoir une dose excessive.
En cas de surdosage, contacter un professionnel de santé (médecin, pharmacien ou infirmier/ère).
En cas d'arrêt du traitement
La décision d’arrêter d’utiliser ROACTEMRA® doit être discutée avec le médecin. Les symptômes peuvent revenir à l’arrêt du traitement.
Situations particulières
Vaccination
Voyage
Conduite de véhicules et utilisation de machines : ce médicament peut provoquer des étourdissements. En cas détourdissements, l'abstention de conduite de véhicules et d'utiliser de machines est requise.
- Les vaccins vivants et les vaccins vivants atténués ne doivent pas être administrés pendant le traitement.
- Il est recommandé que tous les patients, en particulier les patients atteints d’AJIs et d’AJIp, soient à jour de leurs vaccinations avant de débuter un traitement.
- L’intervalle entre l’administration d’un vaccin vivant et le début du traitement par ROACTEMRA® doit respecter les recommandations vaccinales en vigueur concernant les médicaments immunosuppresseurs.
Voyage
- Si une injection est prévue pendant le voyage, le médicament doit être transporté dans un coffret isotherme, puis remis au frais dès l'arrivée.
- En cas d'utilisation des transports aériens : nécessité de voyager avec son ordonnance et un certificat, de préférence en anglais, justifiant le traitement et sa conservation dans le coffret isotherme en cabine (idéalement, prendre contact au préalable avec la compagnie aérienne pour connaître leurs procédures).
Conduite de véhicules et utilisation de machines : ce médicament peut provoquer des étourdissements. En cas détourdissements, l'abstention de conduite de véhicules et d'utiliser de machines est requise.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients
Infections sévères et incontrôlées telles que sepsis et infections opportunistes
Se reporter au RCP
Grossesse et allaitement
Source
Femmes enceintes :
Allaitement :
Fertilité : Les données disponibles jusqu’à présent ne suggèrent pas d’effet de ce traitement sur la fécondité.
- Si le tocilizumab est indispensable car les options thérapeutiques mieux connues ne conviennent pas (certolizumab, anakinra…), son utilisation est envisageable en cours de grossesse.
- Programmer si possible une dernière administration de tocilizumab au début du 3ème trimestre afin de limiter l’exposition du nouveau-né (longue demi-vie d’élimination plasmatique).
- Tenir compte d’un risque potentiellement accru d’infection materno-fœtale (listériose, CMV, toxoplasmose…) en raison de l’immunosuppression induite par le traitement.
- Considérer le fœtus et/ou l’enfant comme immunodéprimé pendant les 10 semaines qui suivent la dernière injection maternelle (vie fœtale comprise) (cf. Etat des connaissances).
- Avertir le pédiatre prenant en charge le nouveau-né du traitement maternel pour adapter sa prise en charge, en particulier sur le plan infectieux.
Allaitement :
- Au vu des données disponibles sur le tocilizumab et l’allaitement (cf. Etat des connaissances), son utilisation est envisageable chez une femme qui allaite.
Fertilité : Les données disponibles jusqu’à présent ne suggèrent pas d’effet de ce traitement sur la fécondité.
Conditions de prescription et de délivrance
Source Meddispar
Médicament d'exception à prescription initiale hospitalière annuelle réservée aux spécialistes et services de :
Durée maximale de prescription 1 an.
- médecine interne,
- rhumatologie,
- pédiatrie (uniquement pour la seringue préremplie)
Durée maximale de prescription 1 an.
Informations médicales
Service d’information médicale :
- Par téléphone : 01 47 61 47 61
- Par Email: paris.imp@roche.com
Commande
Auprès de votre grossiste répartiteur
Directement auprès du laboratoire ROCHE : 01 47 61 61 61.
Directement auprès du laboratoire ROCHE : 01 47 61 61 61.
Modalités de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
Conserver dans son emballage extérieur à l'abri de la lumière et de l'humidité.
Une fois sorti du réfrigérateur, ROACTEMRA® doit être administré dans les 8 heures et doit être conservé à une température ne dépassant pas 30°C.
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Conserver dans son emballage extérieur à l'abri de la lumière et de l'humidité.
Une fois sorti du réfrigérateur, ROACTEMRA® doit être administré dans les 8 heures et doit être conservé à une température ne dépassant pas 30°C.
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.