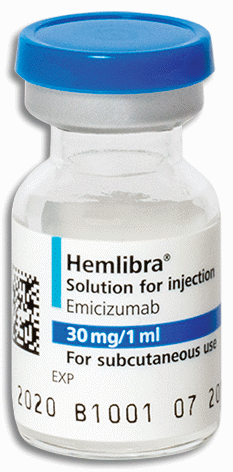
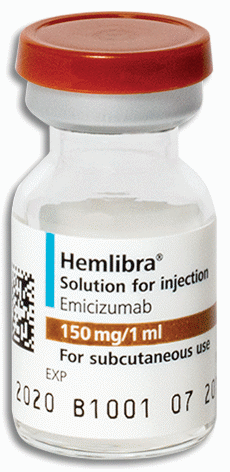
Microangiopathie thrombotique (maladie entrainant une obstruction des petits vaisseaux sanguins)
Cette affection grave pouvant engager le pronostic vital est liée à l’utilisation de l’aPCC (concentrés de complexe de prothrombine activé) pendant un traitement par HEMLIBRA®. La paroi des petits vaisseaux sanguins peut être endommagée et des caillots sanguins peuvent s’y développer. Dans certains cas, cette affection peut entraîner des atteintes au niveau des reins et d’autres organes.
La vigilance est requise en cas de :
- risque élevé de développement de cette affection (antécédents familiaux de microangiopathie thrombotique), ou,
- prise concomitante de médicaments qui en augmentent le risque, tels que : ciclosporine, quinine, ou tacrolimus.
En cas de survenue de l'un des symptômes suivants : confusion, faiblesse, gonflement des bras et des jambes, jaunissement de la peau et des yeux, douleur vague au niveau du ventre (abdomen) ou du dos, mal au coeur (nausées), vomissements ou diminution de la quantité d’urine, les traitement par HEMLIBRA® et l’aPCC doivent être arrêtés et une consultation médicale d'urgence est requise.
Evénements thromboemboliques (caillots sanguins)
Cet effet survient lors de l’utilisation de concentré de facteurs du complexe prothrombique activé (aPCC), au cours du traitement par HEMLIBRA®.
Dans de rares cas, un caillot sanguin peut se former à l’intérieur des vaisseaux et les obstruer, engageant ainsi le pronostic vital.
Les traitements par HEMLIBRA et aPCC doivent être arrêtés et une consultation médicale d'urgence est requise en cas de survenue de l'un des symptômes suivants :
- gonflement, chaleur, douleur ou rougeur : ils peuvent être les signes de la présence d’un caillot sanguin dans une veine à proximité de la surface de la peau;
- maux de tête, engourdissement du visage, douleur ou gonflement au niveau des yeux ou altération de la vision : ils peuvent être les signes de la présence d’un caillot sanguin dans une veine située derrière l'oeil;
- noircissement de la peau : ce symptôme peut être le signe d’une lésion sévère du tissu cutané.






 Posologie population pédiatrique
Posologie population pédiatrique