BEYFORTUS®
Référence

|
|
| DCI | Nirsévimab |
| ATC | J06BD08 |
| CLASSE | Sérums immunisants et immunoglobulines, anticorps monoclonaux antiviraux |
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Nourrissons au cours de leur première saison de circulation du VRS
La dose recommandée est une dose unique de 50 mg administré par voie intramusculaire pour les nourrissons dont le poids est <5 kg et une dose unique de 100 mg administré par voie intramusculaire pour les nourrissons dont le poids est ≥5 kg.
BEYFORTUS® doit être administré dès la naissance chez les nourrissons nés au cours de la saison d’épidémie à VRS. Pour les nourrissons nés en dehors de la saison, Beyfortus doit être administré idéalement avant la saison d’épidémie à VRS.
Enfants qui demeurent vulnérables à une infection sévère due au VRS au cours de leur deuxième saison de circulation du VRS
La dose recommandée est une dose unique de 200 mg administrée en deux injections intramusculaires (2 x 100 mg). BEYFORTUS® doit être administré idéalement avant le début de la deuxième saison d’épidémie à VRS.
Indications thérapeutiques
BEYFORTUS® est indiqué pour la prévention des infections des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS) chez :
- Les nouveau-nés et les nourrissons au cours de leur première saison de circulation du VRS.
- Les enfants jusqu’à l’âge de 24 mois qui demeurent vulnérables à une infection sévère due au VRS au cours de leur deuxième saison de circulation du VRS.
BEYFORTUS® doit être utilisé conformément aux recommandations officielles en vigueur.
BEYFORTUS® est indiqué pour la prévention des infections des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS) chez :
- Les nouveau-nés et les nourrissons au cours de leur première saison de circulation du VRS.
- Les enfants jusqu’à l’âge de 24 mois qui demeurent vulnérables à une infection sévère due au VRS au cours de leur deuxième saison de circulation du VRS.
BEYFORTUS® doit être utilisé conformément aux recommandations officielles en vigueur.
Population adulte
Pas d'indication chez l'adulte.
Pas d'indication chez l'adulte.
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Nourrissons au cours de leur première saison de circulation du VRS
La dose recommandée est une dose unique de 50 mg administré par voie intramusculaire pour les nourrissons dont le poids est <5 kg et une dose unique de 100 mg administré par voie intramusculaire pour les nourrissons dont le poids est ≥5 kg.
BEYFORTUS® doit être administré dès la naissance chez les nourrissons nés au cours de la saison d’épidémie à VRS. Pour les nourrissons nés en dehors de la saison, Beyfortus doit être administré idéalement avant la saison d’épidémie à VRS.
Enfants qui demeurent vulnérables à une infection sévère due au VRS au cours de leur deuxième saison de circulation du VRS
La dose recommandée est une dose unique de 200 mg administrée en deux injections intramusculaires (2 x 100 mg). BEYFORTUS® doit être administré idéalement avant le début de la deuxième saison d’épidémie à VRS.
Présentations et dosages
BEYFORTUS® 50 mg sol inj en seringue préremplie
BEYFORTUS® 100 mg sol inj en seringue préremplie
BEYFORTUS® 100 mg sol inj en seringue préremplie
Mode d'administration
BEYFORTUS® doit être administré uniquement par voie intramusculaire, par un professionnel de santé.
Il doit être administré par voie intramusculaire, de préférence dans la partie antérolatérale de la cuisse. Le muscle fessier ne doit pas être utilisé systématiquement comme site d’injection en raison du risque de lésion du nerf sciatique.
BEYFORTUS® est disponible sous la forme d’une seringue préremplie de 50 mg et d’une seringue préremplie de 100 mg. Vérifier les étiquettes collées sur l’emballage extérieur et sur la seringue préremplie pour vous assurer d’avoir choisi la présentation correcte requise de 50 mg ou de 100 mg.
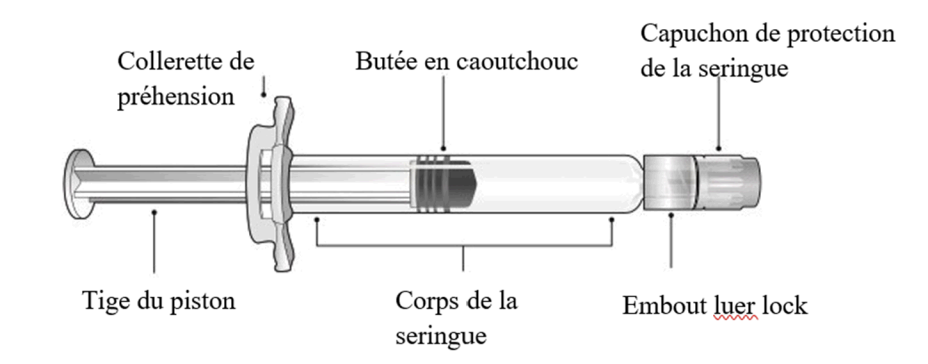
2 - Fixer une aiguille sur la seringue préremplie en tournant délicatement l’aiguille, dans le sens horaire sur l’embout Luer Lock de la seringue préremplie, jusqu’à rencontrer une légère résistance.
3 - En tenant le corps de la seringue d’une main, tirer délicatement sur le capuchon protecteur de l’aiguille avec l’autre main pour l’enlever. Ne pas tenir la tige du piston pendant le retrait du capuchon protecteur de l’aiguille, au risque de déplacer la butée en caoutchouc. Ne pas toucher l’aiguille et ne pas la mettre en contact avec une surface. Ne pas remettre le capuchon protecteur sur l’aiguille et ne pas retirer l’aiguille de la seringue.
4 - Administrer tout le contenu de la seringue préremplie en injection intramusculaire, de préférence dans la face antérolatérale de la cuisse. Le muscle fessier ne doit pas être utilisé systématiquement comme site d’injection en raison du risque de lésion du nerf sciatique.
5 - Jeter immédiatement la seringue usagée, ainsi que l'aiguille, dans un conteneur pour objets tranchants ou conformément aux exigences locales.
Il doit être administré par voie intramusculaire, de préférence dans la partie antérolatérale de la cuisse. Le muscle fessier ne doit pas être utilisé systématiquement comme site d’injection en raison du risque de lésion du nerf sciatique.
BEYFORTUS® est disponible sous la forme d’une seringue préremplie de 50 mg et d’une seringue préremplie de 100 mg. Vérifier les étiquettes collées sur l’emballage extérieur et sur la seringue préremplie pour vous assurer d’avoir choisi la présentation correcte requise de 50 mg ou de 100 mg.
- Seringue préremplie de BEYFORTUS® 50 mg (50 mg/0,5 mL) avec tige de piston violette.
- Seringue préremplie de BEYFORTUS® 100 mg (100 mg/1 mL) avec tige de piston bleue clair.
2 - Fixer une aiguille sur la seringue préremplie en tournant délicatement l’aiguille, dans le sens horaire sur l’embout Luer Lock de la seringue préremplie, jusqu’à rencontrer une légère résistance.
3 - En tenant le corps de la seringue d’une main, tirer délicatement sur le capuchon protecteur de l’aiguille avec l’autre main pour l’enlever. Ne pas tenir la tige du piston pendant le retrait du capuchon protecteur de l’aiguille, au risque de déplacer la butée en caoutchouc. Ne pas toucher l’aiguille et ne pas la mettre en contact avec une surface. Ne pas remettre le capuchon protecteur sur l’aiguille et ne pas retirer l’aiguille de la seringue.
4 - Administrer tout le contenu de la seringue préremplie en injection intramusculaire, de préférence dans la face antérolatérale de la cuisse. Le muscle fessier ne doit pas être utilisé systématiquement comme site d’injection en raison du risque de lésion du nerf sciatique.
5 - Jeter immédiatement la seringue usagée, ainsi que l'aiguille, dans un conteneur pour objets tranchants ou conformément aux exigences locales.
Effets indésirables les plus fréquents
Les effets indésirables rapportés au cours des essais cliniques contrôlés sont répertoriés par classe de systèmes d’organes (SOC) MedDRA.
Aujourd'hui, seuls des EI peu fréquents sont répertoriés dans le RCP de BEYFORTUS®
- Affections de la peau et du tissu souscutané : Eruptions cutanées
- Troubles généraux et anomalies au site d’administration : Réaction au site d’injection, Pyrexie
Conduite à tenir en cas d'effets indésirables
Hypersensibilité, notamment anaphylaxie
Des réactions graves d’hypersensibilité, notamment des cas d’anaphylaxie, ont été observées avec des anticorps monoclonaux. En cas d’apparition de signes et symptômes d’une réaction cliniquement significative d’hypersensibilité ou d’anaphylaxie, arrêter immédiatement l’administration et débuter un traitement médicamenteux et/ou des soins de soutien appropriés.
Troubles hémorragiques cliniquement significatifs
Comme pour tous les médicaments injectables en intramusculaire (IM), il convient de faire preuve de prudence lors de l’administration du nirsévimab à des nourrissons atteints de thrombopénie, ou d’un trouble de la coagulation.
Des réactions graves d’hypersensibilité, notamment des cas d’anaphylaxie, ont été observées avec des anticorps monoclonaux. En cas d’apparition de signes et symptômes d’une réaction cliniquement significative d’hypersensibilité ou d’anaphylaxie, arrêter immédiatement l’administration et débuter un traitement médicamenteux et/ou des soins de soutien appropriés.
Troubles hémorragiques cliniquement significatifs
Comme pour tous les médicaments injectables en intramusculaire (IM), il convient de faire preuve de prudence lors de l’administration du nirsévimab à des nourrissons atteints de thrombopénie, ou d’un trouble de la coagulation.
Conduite à tenir en cas d'oubli de dose
La dose recommandée est une dose unique : l'oubli n'est ici pas applicable.
En cas de surdosage
Il n’existe pas de traitement spécifique en cas de surdosage avec du nirsévimab. En cas de surdosage, il convient de surveiller la survenue d’effets indésirables chez le patient et de lui administrer un traitement symptomatique approprié.
En cas d'arrêt du traitement
La dose recommandée est une dose unique : l'arrêt du traitement n'est ici pas applicable.
Situations particulières
Polysorbate 80 (E433)
Ce médicament contient 0,1 mg de polysorbate 80 pour chaque dose de 50 mg (0,5 mL) et 0,2 mg pour chaque dose de 100 mg (1 mL). Les polysorbates peuvent provoquer des réactions allergiques.
Ce médicament contient 0,1 mg de polysorbate 80 pour chaque dose de 50 mg (0,5 mL) et 0,2 mg pour chaque dose de 100 mg (1 mL). Les polysorbates peuvent provoquer des réactions allergiques.
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients
Grossesse et allaitement
Source
BEYFORTUS® est indiqué pour la prévention des infections des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS) chez les nouveau-nés et les nourrissons au cours de leur première saison de circulation du VRS.
L'administration de BEYFORTUS® chez la femme enceinte ou allaitante n'est pas prévue.
L'administration de BEYFORTUS® chez la femme enceinte ou allaitante n'est pas prévue.
Conditions de prescription et de délivrance
- BEYFORTUS® est soumis à prescription médicale (liste I).
- La prescription de BEYFORTUS® en ambulatoire est établie par le médecin qui suit l'enfant (généraliste, pédiatre, médecin de PMI).
Informations médicales
Service d’information médicale SANOFI :
- Par téléphone : 0800 394 000.
- Par Email sur la page dédiée
Commande
Seuls BEYFORTUS® et ABRYSVO® sont disponibles en ville. SYNAGIS®, BEYFORTUS® et ABRYSVO® sont disponibles dans les établissements de santé et inscrits sur la liste des spécialités agréées aux collectivités.
Ces spécialités seront mises à disposition en ville et dans les établissements de santé via les circuits classiques d’approvisionnement et selon les calendriers prévus par les autorités de santé.
La date de prise en charge de ces traitements coïncide avec les calendriers de démarrage de la campagne d’immunisation en cours.
Commande auprès du grossiste répartiteur.
Modalités de conservation
Durée de conservation
3 ans
Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Ne pas agiter et ne pas exposer à la chaleur directe. Conserver la seringue préremplie dans l’emballage extérieur à l’abri de la lumière.
BEYFORTUS® peut être conservé à température ambiante (20°C 25°C) à l’abri de la lumière pendant 8 heures au maximum. Une fois ce délai écoulé, la seringue doit être jetée.
3 ans
Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Ne pas agiter et ne pas exposer à la chaleur directe. Conserver la seringue préremplie dans l’emballage extérieur à l’abri de la lumière.
BEYFORTUS® peut être conservé à température ambiante (20°C 25°C) à l’abri de la lumière pendant 8 heures au maximum. Une fois ce délai écoulé, la seringue doit être jetée.