ENSPRYNG®
Référence| DCI | Satralizumab |
| ATC | L04AC19 |
| CLASSE | Immunosuppresseurs, Inhibiteurs de l'interleukine |
Description de la pathologie
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg (RCP)
Le traitement doit être initié sous la surveillance d’un médecin expérimenté dans le traitement de la neuromyélite optique (NMO) ou des TSNMO.
ENSPRYNG® peut être utilisé en monothérapie ou en association avec des corticoïdes oraux (CO), de l’azathioprine (AZA), ou du mycophénolate mofétil (MMF) . La posologie chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg et chez les patients adultes est identique.
Doses de charge
La posologie recommandée pour la dose de charge est de 120 mg par injection sous-cutanée (SC) toutes les deux semaines pour les trois premières administrations (première dose à la Semaine 0, deuxième dose à la Semaine 2 et troisième dose à la Semaine 4)
Doses d’entretien
La posologie recommandée pour la dose d’entretien est de 120 mg par injection SC toutes les quatre semaines.
Durée du traitement
ENSPRYNG® est destiné à un traitement au long cours.
Indications thérapeutiques
ENSPRYNG® est indiqué en monothérapie ou en association avec un traitement immunosuppresseur (TIS) dans le traitement des troubles du spectre de la neuromyélite optique (TSNMO) chez les patients adultes et les adolescents à partir de 12 ans qui sont séropositifs pour les IgG anti-aquaporine-4 (AQP4-IgG)
ENSPRYNG® est remboursé en monothérapie ou en association avec un traitement immunosuppresseur (TIS) dans le traitement des troubles du spectre de la neuromyélite optique (NMOSD) uniquement chez les patients adultes et les adolescents à partir de 12 ans, séropositifs pour les IgG anti-aquaporine-4 (AQP4IgG), et qui sont atteints de la forme récurrente de la maladie et en échec des traitements de fond immunosuppresseurs (rituximab, azathioprine, mycophénolate mofétil).
ENSPRYNG® est indiqué en monothérapie ou en association avec un traitement immunosuppresseur (TIS) dans le traitement des troubles du spectre de la neuromyélite optique (TSNMO) chez les patients adultes et les adolescents à partir de 12 ans qui sont séropositifs pour les IgG anti-aquaporine-4 (AQP4-IgG)
ENSPRYNG® est remboursé en monothérapie ou en association avec un traitement immunosuppresseur (TIS) dans le traitement des troubles du spectre de la neuromyélite optique (NMOSD) uniquement chez les patients adultes et les adolescents à partir de 12 ans, séropositifs pour les IgG anti-aquaporine-4 (AQP4IgG), et qui sont atteints de la forme récurrente de la maladie et en échec des traitements de fond immunosuppresseurs (rituximab, azathioprine, mycophénolate mofétil).
Population adulte
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Le traitement doit être initié sous la surveillance d’un médecin expérimenté dans le traitement de la neuromyélite optique (NMO) ou des TSNMO.
ENSPRYNG® peut être utilisé en monothérapie ou en association avec des corticoïdes oraux (CO), de l’azathioprine (AZA), ou du mycophénolate mofétil (MMF) . La posologie chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg et chez les patients adultes est identique.
Doses de charge
120 mg par injection sous-cutanée (SC) toutes les deux semaines pour les trois premières administrations (première dose à la Semaine 0, deuxième dose à la Semaine 2 et troisième dose à la Semaine 4)
Doses d’entretien
120 mg par injection SC toutes les quatre semaines.
Durée du traitement
ENSPRYNG® est destiné à un traitement au long cours.
Arrêt du traitement
en cas d’anomalies des enzymes hépatiques
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée (RCP)
Le traitement doit être initié sous la surveillance d’un médecin expérimenté dans le traitement de la neuromyélite optique (NMO) ou des TSNMO.
ENSPRYNG® peut être utilisé en monothérapie ou en association avec des corticoïdes oraux (CO), de l’azathioprine (AZA), ou du mycophénolate mofétil (MMF) . La posologie chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg et chez les patients adultes est identique.
Doses de charge
120 mg par injection sous-cutanée (SC) toutes les deux semaines pour les trois premières administrations (première dose à la Semaine 0, deuxième dose à la Semaine 2 et troisième dose à la Semaine 4)
Doses d’entretien
120 mg par injection SC toutes les quatre semaines.
Durée du traitement
ENSPRYNG® est destiné à un traitement au long cours.
Arrêt du traitement
en cas d’anomalies des enzymes hépatiques
 Posologie population pédiatrique
Posologie population pédiatrique
Posologie du traitement : se référer à la prescription médicale.
Posologie recommandée chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg (RCP)
Le traitement doit être initié sous la surveillance d’un médecin expérimenté dans le traitement de la neuromyélite optique (NMO) ou des TSNMO.
ENSPRYNG® peut être utilisé en monothérapie ou en association avec des corticoïdes oraux (CO), de l’azathioprine (AZA), ou du mycophénolate mofétil (MMF) . La posologie chez les patients adolescents ≥ 12 ans avec un poids corporel ≥ 40kg et chez les patients adultes est identique.
Doses de charge
La posologie recommandée pour la dose de charge est de 120 mg par injection sous-cutanée (SC) toutes les deux semaines pour les trois premières administrations (première dose à la Semaine 0, deuxième dose à la Semaine 2 et troisième dose à la Semaine 4)
Doses d’entretien
La posologie recommandée pour la dose d’entretien est de 120 mg par injection SC toutes les quatre semaines.
Durée du traitement
ENSPRYNG® est destiné à un traitement au long cours.
Présentations et dosages
ENSPRYNG 120 mg - Solution injectable en seringue préremplie
Pour aller plus loin
- Stratégie thérapeutique : HAS 2022
- JO du 9 novembre 2022
- Données réglementaires : RCP
Mode d'administration
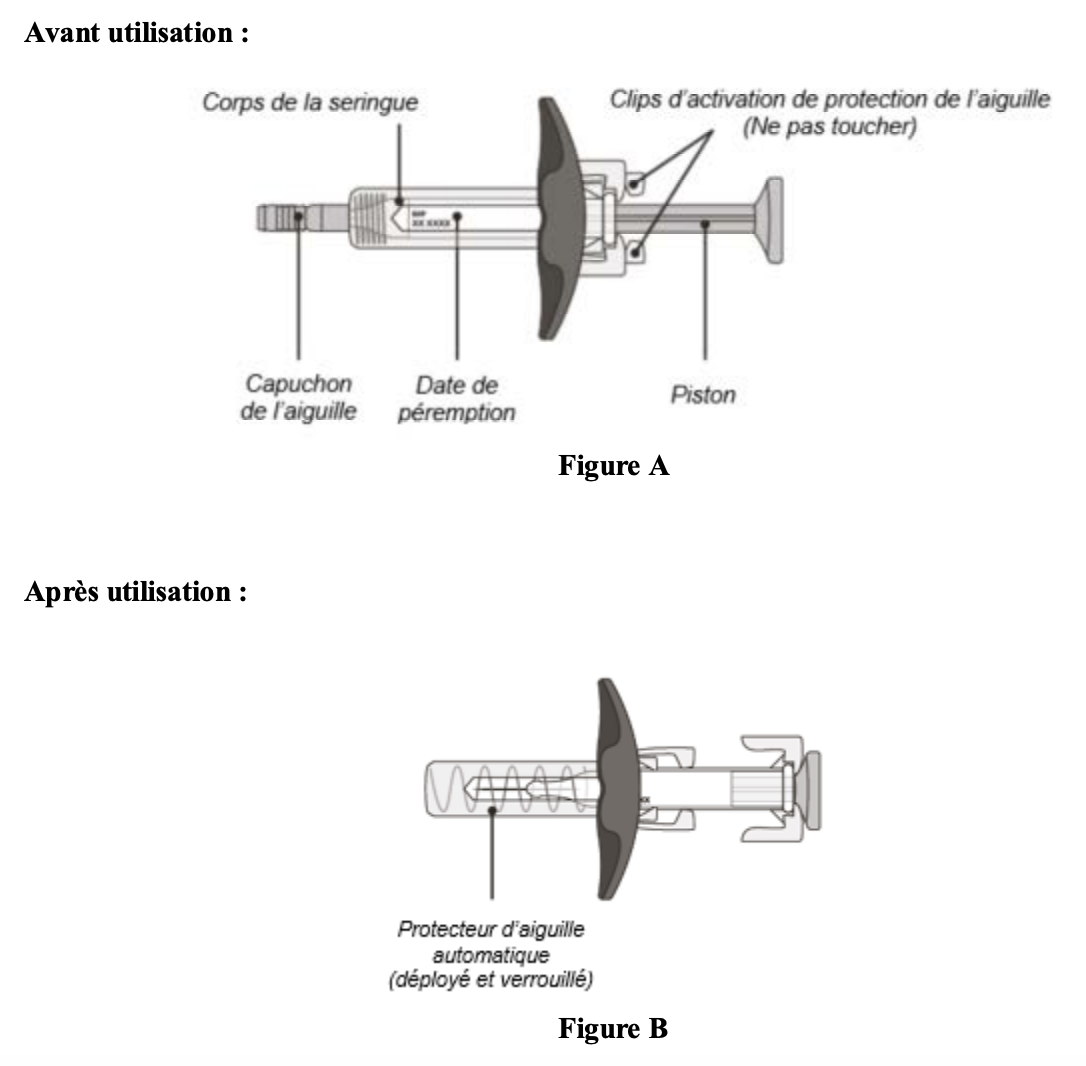
ENSPRYNG® est à administrer en injection sous la peau (voie sous-cutanée). L’auto-injection est possible après une courte formation délivrée par un professionnel de santé.
Laisser la seringue atteindre la température ambiante 30 minutes avant l'utilisation.
1 - Contrôle de la solution
Choisir le site d’injection entre :
3 - Se laver les mains et désinfecter le site d'injection
4 - Injection
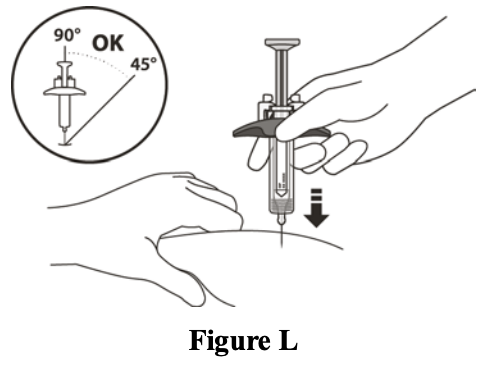
En cas d’utilisation d’une seringue préremplie : Retirer le capuchon en tirant la seringue préremplie avec l’autre main. Injection sous-cutanée, en pinçant la peau, avec un angle de 45° à 90°, jusqu'à ce que l'ensemble du produit soit injecté.
5 - Jeter le dispositif d'injection utilisé dans un collecteur de déchets comme indiqué par votre médecin, infirmier/ère ou pharmacien. Ne pas recycler ou jeter dans les ordures ménagères.
Laisser la seringue atteindre la température ambiante 30 minutes avant l'utilisation.
1 - Contrôle de la solution
- S'assurer de la qualité du matériel et que la date de péremption n'est pas dépassée.
- Vérifier que la solution est limpide, incolore et légèrement jaune
Choisir le site d’injection entre :
- la partie inférieure de votre abdomen (ventre) ou
- l'avant et le milieu de vos cuisses.
- Ne pas injecter dans la zone de 5 cm qui entoure directement le nombril.
- Ne pas injecter le médicament dans un grain de beauté, une cicatrice, un bleu ou dans des régions où la peau est sensible, rouge, dure ou lésée.
3 - Se laver les mains et désinfecter le site d'injection
4 - Injection
En cas d’utilisation d’une seringue préremplie : Retirer le capuchon en tirant la seringue préremplie avec l’autre main. Injection sous-cutanée, en pinçant la peau, avec un angle de 45° à 90°, jusqu'à ce que l'ensemble du produit soit injecté.
5 - Jeter le dispositif d'injection utilisé dans un collecteur de déchets comme indiqué par votre médecin, infirmier/ère ou pharmacien. Ne pas recycler ou jeter dans les ordures ménagères.
Effets indésirables les plus fréquents
Affections hématologiques et du système lymphatique : Hypofibrinogénémie
Troubles du métabolisme et de la nutrition : Hyperlipidémie
Affections psychiatriques : Insomnie
Affections du système nerveux : Céphalées, Migraine
Affections cardiaques : Bradycardie
Affections vasculaires : Hypertension
Affections respiratoires, thoraciques et médiastinales : Rhinite allergique
Affections gastro-intestinales : Gastrite
Affections de la peau et du tissu souscutané : Éruption cutanée, prurit
Affections musculo-squelettiques et systémiques : Arthralgie, Raideur musculosquelettique
Troubles généraux et anomalies au site d’administration : Réactions liées à l’injection, Œdème périphérique
Investigations : Diminution du nombre de globules blancs, Diminution du nombre de neutrophiles, diminution du nombre de plaquettes, augmentation du taux des transaminases, augmentation du taux sanguin de bilirubine, prise de poids
Autres : se référer au RCP.
Troubles du métabolisme et de la nutrition : Hyperlipidémie
Affections psychiatriques : Insomnie
Affections du système nerveux : Céphalées, Migraine
Affections cardiaques : Bradycardie
Affections vasculaires : Hypertension
Affections respiratoires, thoraciques et médiastinales : Rhinite allergique
Affections gastro-intestinales : Gastrite
Affections de la peau et du tissu souscutané : Éruption cutanée, prurit
Affections musculo-squelettiques et systémiques : Arthralgie, Raideur musculosquelettique
Troubles généraux et anomalies au site d’administration : Réactions liées à l’injection, Œdème périphérique
Investigations : Diminution du nombre de globules blancs, Diminution du nombre de neutrophiles, diminution du nombre de plaquettes, augmentation du taux des transaminases, augmentation du taux sanguin de bilirubine, prise de poids
Autres : se référer au RCP.
Conduite à tenir en cas d'effets indésirables
Infections
Le patient ne peut pas utiliser ENSPRYNG® s'il une infection. Informer immédiatement son médecin ou infirmier/ère s'il pense avoir des signes d’infection avant, pendant, ou après un traitement par ENSPRYNG®, tels que : fièvre ou frissons, toux qui ne disparaît pas, maux de gorge, bouton de fièvre ou lésions génitales (herpes simplex), zona (herpes zoster), rougeur, gonflement, sensibilité ou douleur au niveau de la peau, envie de vomir ou vomissements, diarrhée ou maux de ventre.
Enzymes hépatiques
ENSPRYNG® peut avoir des effets sur le foie et augmenter le taux de certaines enzymes hépatiques dans le sang. Le médecin du patient réalisera des examens sanguins avant de lui administrer ENSPRYNG®, ainsi que pendant le traitement pour vérifier le bon fonctionnement de son foie. Informer immédiatement son médecin ou infirmier/ère s'il présente l’un de ces signes d’atteinte du foie pendant ou après sp, traitement par ENSPRYNG® : coloration jaune de la peau et du blanc des yeux (jaunisse) urines foncées, envie de vomir ou vomissements, douleur abdominale.
Réactions allergiques
Consulter immédiatement un médecin ou rendez vous dans le service des urgences de l’hôpital le plus proche, si le patient présente un des signes de réactions allergiques au cours ou après une injection. Ces signes incluent : oppression au niveau de la poitrine ou respiration sifflante, sensation d’essoufflement, fièvre ou frissons, vertiges ou étourdissements sévères, gonflement des lèvres, de la langue, du visage, démangeaisons, urticaire ou éruption cutanée. Ne pas injecter la dose suivante tant que le patient n'a pas parlé avec son médecin et que celui-ci ne lui ait dit qu'il pouvait pratiquer l’injection suivante.
Réactions liées à l’injection
Dans la plupart des cas, les réactions sont d’intensité légère, mais certaines peuvent être graves. Informer immédiatement son médecin ou infirmier/ère si le patient présente l’un de ces signes au cours ou après une injection - en particulier au cours des 24 premières heures après l’injection : rougeurs, démangeaisons, douleur ou gonflement au niveau du site d’injection, éruption cutanée, rougeurs ou démangeaisons cutanées ou urticaire, bouffées de chaleur, maux de tête, irritation, gonflement ou douleur au niveau de la gorge, sensation d’essoufflement, diminution de la tension artérielle (vertiges et étourdissements), fièvre ou frissons, sensation de fatigue, envie de vomir ou vomissements, ou diarrhée, rythme rapide du cœur, sensation de battements ou de pulsations dans votre poitrine (palpitations). Informer immédiatement son médecin ou votre infirmier/ère si le patiente présente l’un des signes mentionnés ci-dessus.
Le patient ne peut pas utiliser ENSPRYNG® s'il une infection. Informer immédiatement son médecin ou infirmier/ère s'il pense avoir des signes d’infection avant, pendant, ou après un traitement par ENSPRYNG®, tels que : fièvre ou frissons, toux qui ne disparaît pas, maux de gorge, bouton de fièvre ou lésions génitales (herpes simplex), zona (herpes zoster), rougeur, gonflement, sensibilité ou douleur au niveau de la peau, envie de vomir ou vomissements, diarrhée ou maux de ventre.
Enzymes hépatiques
ENSPRYNG® peut avoir des effets sur le foie et augmenter le taux de certaines enzymes hépatiques dans le sang. Le médecin du patient réalisera des examens sanguins avant de lui administrer ENSPRYNG®, ainsi que pendant le traitement pour vérifier le bon fonctionnement de son foie. Informer immédiatement son médecin ou infirmier/ère s'il présente l’un de ces signes d’atteinte du foie pendant ou après sp, traitement par ENSPRYNG® : coloration jaune de la peau et du blanc des yeux (jaunisse) urines foncées, envie de vomir ou vomissements, douleur abdominale.
Réactions allergiques
Consulter immédiatement un médecin ou rendez vous dans le service des urgences de l’hôpital le plus proche, si le patient présente un des signes de réactions allergiques au cours ou après une injection. Ces signes incluent : oppression au niveau de la poitrine ou respiration sifflante, sensation d’essoufflement, fièvre ou frissons, vertiges ou étourdissements sévères, gonflement des lèvres, de la langue, du visage, démangeaisons, urticaire ou éruption cutanée. Ne pas injecter la dose suivante tant que le patient n'a pas parlé avec son médecin et que celui-ci ne lui ait dit qu'il pouvait pratiquer l’injection suivante.
Réactions liées à l’injection
Dans la plupart des cas, les réactions sont d’intensité légère, mais certaines peuvent être graves. Informer immédiatement son médecin ou infirmier/ère si le patient présente l’un de ces signes au cours ou après une injection - en particulier au cours des 24 premières heures après l’injection : rougeurs, démangeaisons, douleur ou gonflement au niveau du site d’injection, éruption cutanée, rougeurs ou démangeaisons cutanées ou urticaire, bouffées de chaleur, maux de tête, irritation, gonflement ou douleur au niveau de la gorge, sensation d’essoufflement, diminution de la tension artérielle (vertiges et étourdissements), fièvre ou frissons, sensation de fatigue, envie de vomir ou vomissements, ou diarrhée, rythme rapide du cœur, sensation de battements ou de pulsations dans votre poitrine (palpitations). Informer immédiatement son médecin ou votre infirmier/ère si le patiente présente l’un des signes mentionnés ci-dessus.
Conduite à tenir en cas d'oubli de dose
En cas d’oubli d’une injection, pour toute autre raison que la survenue d'effets indésirables, celle-ci doit être administrée comme décrit dans le tableau 1 de la section 4.2 du rcp, page 3.
Oubli d’une dose de charge ou dose retardée de moins de 8 semaines pendant la phase d’entretien:
La dose recommandée doit être administrée le plus tôt possible sans attendre la prochaine dose planifiée.
La dose recommandée doit être administrée aux semaines 0* (au moment de la première administration après la dose oubliée), 2 et toutes les 4 semaines par la suite.
12 semaines ou au-delà
La dose recommandée doit être administrée aux semaines 0* (au moment de la première administration après la dose oubliée), 2, 4 et toutes les 4 semaines par la suite.
Oubli d’une dose de charge ou dose retardée de moins de 8 semaines pendant la phase d’entretien:
La dose recommandée doit être administrée le plus tôt possible sans attendre la prochaine dose planifiée.
- Phase initiale : si la seconde dose de charge est retardée ou oubliée, cette dose doit être administrée le plus tôt possible et la troisième et dernière dose de charge 2 semaines plus tard. Si la troisième dose de charge est retardée ou oubliée, cette dose doit être administrée le plus tôt possible et la première dose d’entretien 4 semaines plus tard.
- Phase d’entretien : près avoir administré la dose retardée ou oubliée, le rythme d’administration doit être rétabli toutes les 4 semaines.
La dose recommandée doit être administrée aux semaines 0* (au moment de la première administration après la dose oubliée), 2 et toutes les 4 semaines par la suite.
12 semaines ou au-delà
La dose recommandée doit être administrée aux semaines 0* (au moment de la première administration après la dose oubliée), 2, 4 et toutes les 4 semaines par la suite.
En cas de surdosage
En cas de surdosage, le patient doit être étroitement surveillé, recevoir un traitement symptomatique, et une prise en charge doit être instaurée, si nécessaire.
En cas d'arrêt du traitement
La décision d’arrêter l’utilisation de ENSPRYNG® doit être discutée avec un médecin. Les symptômes pouvent revenir après l’arrêt du traitement.
Situations particulières
Vaccination
Ce médicament pouvant modifier l’immunité, des recommandations vaccinales spécifiques s’appliquent afin de réduire le risque d’infections graves ; il convient de se référer au calendrier vaccinal en vigueur. Les vaccins vivants atténués (ROR, BCG, vaccins contre les infections à rotavirus, la varicelle, la fièvre jaune, la dengue) sont contre-indiqués en cas d'immunodépression congénitale ou acquise tant que l'immunodépression persiste, sauf cas particuliers. La vaccination de l’entourage et des professionnels de santé en contact étroit est également recommandée afin de limiter la transmission d’infections et d’assurer une protection indirecte.
Nombre de neutrophiles
Des diminutions du nombre de neutrophiles sont apparues après un traitement par satralizumab. Le nombre de neutrophiles doit être contrôlé 4 à 8 semaines après le début du traitement et par la suite si indiqué d’un point de vue clinique.
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
ENSPRYNG® n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Ce médicament pouvant modifier l’immunité, des recommandations vaccinales spécifiques s’appliquent afin de réduire le risque d’infections graves ; il convient de se référer au calendrier vaccinal en vigueur. Les vaccins vivants atténués (ROR, BCG, vaccins contre les infections à rotavirus, la varicelle, la fièvre jaune, la dengue) sont contre-indiqués en cas d'immunodépression congénitale ou acquise tant que l'immunodépression persiste, sauf cas particuliers. La vaccination de l’entourage et des professionnels de santé en contact étroit est également recommandée afin de limiter la transmission d’infections et d’assurer une protection indirecte.
Nombre de neutrophiles
Des diminutions du nombre de neutrophiles sont apparues après un traitement par satralizumab. Le nombre de neutrophiles doit être contrôlé 4 à 8 semaines après le début du traitement et par la suite si indiqué d’un point de vue clinique.
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
ENSPRYNG® n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients
Grossesse et allaitement
Source
Grossesse
Il n’existe pas de donnée sur l’utilisation du satralizumab chez la femme enceinte.
Par mesure de précaution, il est préférable d’éviter l’utilisation d’Enspryng pendant la grossesse.
Allaitement
Il est inconnu si le satralizumab est excrété dans le lait maternel. Il est connu que les IgG chez l’homme sont excrétées dans le lait maternel pendant les premiers jours suivant la naissance mais leur taux diminue rapidement jusqu’à des concentrations faibles ; par conséquent, un risque pour les 7 nourrissons allaités au sein ne peut être exclu pendant cette courte période. Par la suite, l’utilisation d’Enspryng pourrait être envisagée pendant l’allaitement, uniquement si cela est nécessaire sur le plan clinique.
Fertilité
Aucune donnée clinique n’est disponible sur l’effet du satralizumab sur la fertilité chez l’homme. Les études chez l’animal n’ont montré aucune altération de la fertilité chez l’homme ou chez la femme.
Il n’existe pas de donnée sur l’utilisation du satralizumab chez la femme enceinte.
Par mesure de précaution, il est préférable d’éviter l’utilisation d’Enspryng pendant la grossesse.
Allaitement
Il est inconnu si le satralizumab est excrété dans le lait maternel. Il est connu que les IgG chez l’homme sont excrétées dans le lait maternel pendant les premiers jours suivant la naissance mais leur taux diminue rapidement jusqu’à des concentrations faibles ; par conséquent, un risque pour les 7 nourrissons allaités au sein ne peut être exclu pendant cette courte période. Par la suite, l’utilisation d’Enspryng pourrait être envisagée pendant l’allaitement, uniquement si cela est nécessaire sur le plan clinique.
Fertilité
Aucune donnée clinique n’est disponible sur l’effet du satralizumab sur la fertilité chez l’homme. Les études chez l’animal n’ont montré aucune altération de la fertilité chez l’homme ou chez la femme.
Conditions de prescription et de délivrance
Source MeddisparPrescription hospitalière réservée à certains médecins spécialistes :
- aux spécialistes et services NEUROLOGIE
- aux spécialistes et services NEUROPEDIATRIE
Informations médicales
Service d’information médicale ROCHE :
- Par téléphone : 01 47 61 47 61
- Par Email: paris.imp@roche.com
Commande
Auprès de votre grossiste répartiteur
Directement auprès du laboratoire ROCHE : 01 47 61 61 61.
Directement auprès du laboratoire ROCHE : 01 47 61 61 61.
Modalités de conservation
Durée de conservation
3 ans
Précautions particulières de conservation
À conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Ne pas utiliser la seringue si elle a été congelée. Conserver toujours la seringue au sec.
Conserver la seringue préremplie dans l’emballage extérieur à l’abri de la lumière et de l’humidité. A condition qu’elle ne soit pas ouverte et soit conservée dans l’emballage extérieur, la seringue peut être laissée hors du réfrigérateur à une température inférieure à 30°C pendant une période unique pouvant aller jusqu’à 8 jours.
Après conservation à température ambiante, le produit ne doit pas être remis au réfrigérateur et doit être utilisé ou jeté.
Tenir hors de la vue et de la portée des enfants.
3 ans
Précautions particulières de conservation
À conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Ne pas utiliser la seringue si elle a été congelée. Conserver toujours la seringue au sec.
Conserver la seringue préremplie dans l’emballage extérieur à l’abri de la lumière et de l’humidité. A condition qu’elle ne soit pas ouverte et soit conservée dans l’emballage extérieur, la seringue peut être laissée hors du réfrigérateur à une température inférieure à 30°C pendant une période unique pouvant aller jusqu’à 8 jours.
Après conservation à température ambiante, le produit ne doit pas être remis au réfrigérateur et doit être utilisé ou jeté.
Tenir hors de la vue et de la portée des enfants.